
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
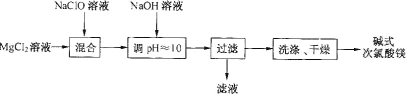
(1)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:_____。
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
①通过计算判断该产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)_____________
②根据你的判断,推测产品中可能含有的杂质,并给出制备过程能减少产品中含有该杂质的措施_____________
【答案】NaCl Cl2+2NaOH=NaCl+NaCl+H2O Mg2ClO(OH)3·H2O的摩尔质量为168.5g·mol-1,Mg2ClO(OH)3·H2O中镁含量的理论值:![]() =28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:
=28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:![]() =42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低 Mg(OH)2等杂质;制备过程能减少产品中含有该杂质的措施:在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)
=42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低 Mg(OH)2等杂质;制备过程能减少产品中含有该杂质的措施:在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)
【解析】
(1)从上述流程中可以看出,Mg2+、ClO-、OH-都进入沉淀中,则滤液中含有Na+、Cl-;
(2)Cl2与NaOH溶液反应获得NaCl、NaClO等;
(3)①Mg2ClO(OH)3·H2O的摩尔质量为168.5 g·mol-1,Mg2ClO(OH)3·H2O中镁含量的理论值:![]() =28.49%,根据实际镁含量与理论镁含量相比,确定偏高还是偏低,Mg2ClO(OH)3·H2O中有效氯含量的理论值:
=28.49%,根据实际镁含量与理论镁含量相比,确定偏高还是偏低,Mg2ClO(OH)3·H2O中有效氯含量的理论值:![]() =42.14%,根据实际有效氯含量与理论有效氯含量相比,确定偏高还是偏低。
=42.14%,根据实际有效氯含量与理论有效氯含量相比,确定偏高还是偏低。
②通过比较确定镁含量变化,推测产品中可能含有Mg(OH)2、MgCl2、Mg(ClO)2中的某一种或几种,并制订制备过程能减少杂质的措施。
(1)从上述流程中可以看出,Mg2+、ClO-、OH-都进入沉淀中,则滤液中含有Na+、Cl-,可回收的主要物质是NaCl;
(2)Cl2与NaOH溶液反应获得NaClO,反应的化学方程式为Cl2+2NaOH=NaCl+NaCl+H2O;
(3)①Mg2ClO(OH)3·H2O的摩尔质量为168.5g·mol-1,Mg2ClO(OH)3·H2O中镁含量的理论值:![]() =28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:
=28.49%,产品中镁含量的测定值为29.01%,大于28.49%,比理论值偏高;由Mg2ClO(OH)3·H2O~ClO-~Cl2,Mg2ClO(OH)3·H2O中有效氯含量的理论值:![]() =42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低。
=42.14%,产品中有效氯含量的测定值为40.28%,小于42.14%,比理论值偏低。
②由于产品中有效氯含量偏低而镁含量偏高,据此推测产品中可能含有Mg(OH)2等杂质[只填MgCl2或Mg(ClO)2不对,因为Mg(OH)2中镁元素含量为41.38%;MgCl2中镁元素含量为25.26%;Mg(ClO)2中镁元素含量为18.90%,有效氯含量为111.8%];制备过程能减少产品中含有该杂质的措施:在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)。答案为:Mg(OH)2等杂质;在形成沉淀的过程中加速搅拌、缓慢滴加NaOH溶液等(答出一点即可)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
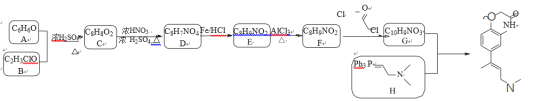
【题目】已知某有机物K的合成路线如下所示:
已知:①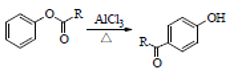
②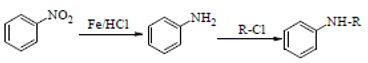
③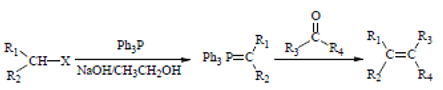
(Ph表示苯基,R、R1、R2、R2、R3表示烃基或氢原子)
(1)下列说法正确的是_________
A.有机物K的分子式为C14H17N2O2
B.可用FeCl3溶液来帮助判断反应E→F是否完全
C.已知RCOCl的性质与酯相似,1mol有机物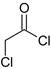 最多能与3molNaOH反应
最多能与3molNaOH反应
D.发生反应E→F,其有机物的水溶性增强
(2)写出有机物B的结构简式_________。
(3)写出F→G的化学方程式_________。
(4)请设计以乙醇和Ph3P为原料合成正丁烷的合成路线_________(用流程图表示,无机试剂任选)。
(5)写出化合物D(C8H7NO4)可能的同分异构体的结构简式_________。
须同时符合:①能使FeCl3溶液显紫色,1mol有机物能与足量银氨溶液反应生成4molAg;②1H-NMR谱显示分子中有4种氢原子;③分子中无N-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A. 若x=y,且a+b=14,则pH>7B. 若10x=y,且a+b=13,则pH=7
C. 若ax=by,且a+b=13,则pH=7D. 若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种用于分离镧系金属的化合物 A,其结构如下图所示。短周期元素 X、Y、Z原子序数依次增大,其中Z位于第三周期。Z与Y可以形成分子 ZY6,该分子常用作高压电气设备的绝缘介质。下列关于X、Y、Z的叙述,正确的是

A.化合物 A中,X、Y、Z最外层都达到8电子稳定结构
B.离子半径:Y>Z
C.最简单氢化物的沸点:Z>Y
D.最高价氧化物对应水化物的酸性:Z<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
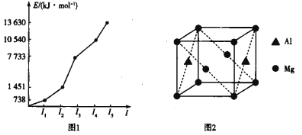
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:

①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
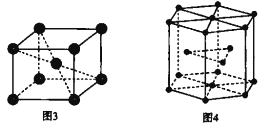
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. 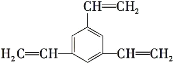
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为还原剂的是( )
A.3Fe+4H2O![]() Fe3O4+4H2B.3NO2+H2O = 2HNO3+ NO
Fe3O4+4H2B.3NO2+H2O = 2HNO3+ NO
C.2Na2O2+2H2O = 4NaOH+O2↑D.2F2+2H2O = 4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
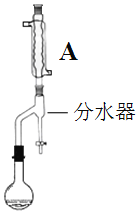
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是________。
(2)步骤2中,图中所示装置中仪器A的名称是______,其作用为_______。
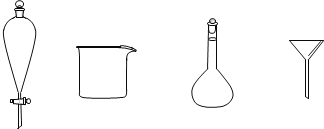
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为_______,分离有机相时不需要用到下列玻璃仪器中的_______(填名称)。
(4)实验中可能生成的有机副产物结构简式为_______ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com