
【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
【答案】a>b>d>c 9×108 CN-+CO2+H2O=HCO3-+HCN 9.9×10-7mol·L-1(或10-6-10-8) 18 ![]() 10 10-3moL/L
10 10-3moL/L
【解析】
(1)酸越弱,对应酸根离子的水解程度越大,所以pH由大到小的顺序是a>b>d>c;
(2)Ka(CH3COOH)=![]() =
=![]() =1.8×10-5,c(CH3COOH)≈0.5mol·L-1,则c(H+)≈3×10-3mol·L-1,由水电离出的c(H+)约为
=1.8×10-5,c(CH3COOH)≈0.5mol·L-1,则c(H+)≈3×10-3mol·L-1,由水电离出的c(H+)约为![]() mol·L-1,故由醋酸电离出的c(H+)约是由水电离出的c(H+)的
mol·L-1,故由醋酸电离出的c(H+)约是由水电离出的c(H+)的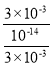 =9×108倍。
=9×108倍。
(3)酸性强弱顺序为H2CO3>HCN>HCO3-,所以向氰化钠溶液中通入少量二氧化碳的离子方程式为CN-+CO2+H2O=HCO3-+HCN。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,c(H+)=10-6mol·L-1,c(OH-)=10-8mol·L-1,则溶液中c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol·L-1-10-8 mol·L-1=9.9×10-7mol·L-1。通过电离平衡常数的表达式可知c(CH3COO-)/c(CH3COOH)=K(CH3COOH)/c(H+)=18;
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7mol·L-1,c(CH3COO-)=c(Na+)=![]() mol·L-1,剩余的c(CH3COOH)=
mol·L-1,剩余的c(CH3COOH)=![]() mol·L-1,则Ka=
mol·L-1,则Ka=![]() =
=![]() 。
。
(6)纯水中的c(H+)=c(OH-),pH=6,c(H+)=c(OH-)=1×10-6molL-1,KW=1×10-6×1×10-6=1×10-12,0.01molL-1的NaOH溶液中氢氧根离子浓度为0.01mol/L,c(H+)=1×10-10molL-1,pH=-lgc(H+)=10;温度不变,水的离子积不变KW=1×10-12,pH=9的碳酸钠溶液中氢离子是由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH-),故水电离出c(OH-)=c(H+)=10-3mol/L。


科目:高中化学 来源: 题型:
【题目】图中的A为直流电源,B为渗透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
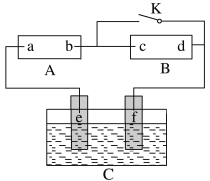
(1)电源A中a点为________极。
(2)滤纸B上发生氧化反应的电极反应方程式为:____________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路:
①电极e上发生的反应为:__________________;
②在此过程中电解液的浓度(填“始终不变”、“略微增大”、“略微减小”)___________;
③电镀槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50℃时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
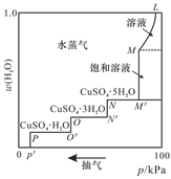
A.曲线L-M对应溶液中无硫酸铜晶体析出
B.曲线M-M对应溶液溶质的质量分数保持不变
C.曲线M- N对应体系存在平衡:CuSO4(饱和溶液)![]() CuSO4·5H2O(s)+H2O(g)
CuSO4·5H2O(s)+H2O(g)
D.当容器中压强低于p后得到无水硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
A. 升高温度
B. 恒温恒容再充入a mol CO和2a mol H2
C. 恒温恒容再充入H2
D. 充入Ar(g)使体系的总压增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4、NaOH混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )

A. 0.100 mol·L-1NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
C. P点:c(Na+)+c(H2C2O4)<0.100mol·L-1+c(C2O42-)
D. 该温度下H2C2O4的电离常数Ka2=1×10-4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳呼吸电池被誉为改变世界的创新技术,设想用碳呼吸电池为锂硫电池充电的装置如下图所示,下列说法不正确的是
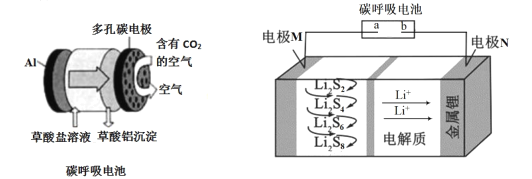
A.a极是多孔碳电极
B.充电时,外电路中流过0.02 mol电子,电极N质量增加0.14 g
C.随着反应的进行,碳呼吸电池中C2O42- 数目不断减小
D.充电时间越长,电池中的Li2S8量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
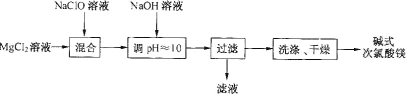
(1)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:_____。
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
①通过计算判断该产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)_____________
②根据你的判断,推测产品中可能含有的杂质,并给出制备过程能减少产品中含有该杂质的措施_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3 是一种重要的无机化合物,常作为食盐中的补碘剂,工业上常用“KClO3 氧化法”制备 KIO3,其中酸化反应的产物有 KH(IO3)2、Cl2 和 KCl,流程如下:
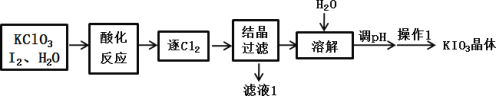
下列说法错误的是
A.酸化反应中还原产物为 KH(IO3)2
B.结晶过滤得到滤液 1 为 KCl 溶液
C.调节 pH 可加入 KOH,发生反应 KH(IO3)2+ KOH=2KIO3+ H2O
D.操作 1 可采用蒸发浓缩、冷却结晶的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com