
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
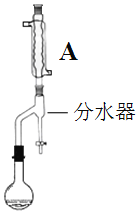
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是________。
(2)步骤2中,图中所示装置中仪器A的名称是______,其作用为_______。
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为_______,分离有机相时不需要用到下列玻璃仪器中的_______(填名称)。
(4)实验中可能生成的有机副产物结构简式为_______ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为______%。
【答案】防止暴沸 球形冷凝管 冷凝回流 分液 容量瓶,漏斗; CH3OCH3 75%
【解析】
(1)根据碎瓷片作用进行分析;
(2)根据仪器A的构造进行分析;
(3)根据分离互不相溶的液体所需的仪器进行分析;
(4)在浓硫酸加热的条件下,醇分子间可发生脱水生成醚的反应;
(5)根据甲醇和丙烯酸反应方程式得出,二者1:1反应,说明甲醇过量,所以根据丙烯酸的物质的量计算丙烯酸甲酯的理论产量,根据实际产量/理论产量×100%可求出产率。
(1)步骤1中,加入碎瓷片的目的是为了防止爆沸;
故答案是:防止暴沸;
(2)仪器A的名称是球形冷凝管,冷凝管的作用为冷凝回流;
故答案是:球形冷凝管;冷凝回流;
(3)分离有机相和水,可以通过分液的方式进行操作;需要的仪器有:分液漏斗和烧杯,用不到的仪器主要有容量瓶和漏斗;
故答案是:分液;容量瓶,漏斗;
(4)实验的条件为浓硫酸加热,可发生甲醇分子间脱水反应生成甲醚的副反应;
故答案是:CH3OCH3;
(5)根据表中数据得出,甲醇有7.9g,丙烯酸有10g,所以甲醇有0.25mol,丙烯酸有0.11mol,根据反应方程式得出,二者1:1反应,说明甲醇过量,所以根据丙烯酸的物质的量计算,0.11mol丙烯酸理论上可以生成0.11mol的丙烯酸甲酯,所以理论丙烯酸甲酯的产量为8.6g,所以计算产率得到![]() ×100%=75%;
×100%=75%;
故答案是:75%。


科目:高中化学 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
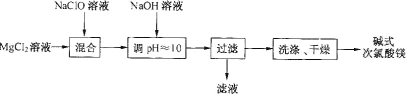
(1)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:_____。
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
①通过计算判断该产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)_____________
②根据你的判断,推测产品中可能含有的杂质,并给出制备过程能减少产品中含有该杂质的措施_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,22.4 L CCl4 含有的碳原子数是 NA
B.56 g Fe 与足量稀盐酸反应转移的电子数为 3 NA
C.0.1 mol/L Na2SO4 溶液含有的钠离子数为 0.2 NA
D.常温常压下,2g H2 中含有的分子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.铁与盐酸反应:2Fe+6H+==2 Fe3++ H2↑
B.在氯化铝溶液中滴加过量的氨水:Al3++4 OH﹣═ AlO![]() +2 H2O
+2 H2O
C.向氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH﹣═ Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体均处于25℃,有关叙述正确的是
A. 某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C. pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
D. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1LpH=2的HCl溶液分别与0.01mol·L-1的NH3· H2O溶液x L、0.01 mol·L-1的NaOH溶液yL充分反应至中性,x、y大小关系为:y___x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是____(填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
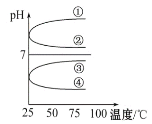
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的____曲线(填写序号)。
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+)___2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH___7(填“>”“=”或“<”)
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是____(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能还有K+、Ag+、Ca2+、Ba2+、NO3-、CO32-、SiO32-、SO42-中的若干种,现取该溶液100mL进行如下实验
已知:H2SiO3为不容水的胶状沉淀,加热时易分解为两种物质
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标况下0.56L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定存在的离子是______________;一定不存在的离子是____________。
(2)实验Ⅱ中沉淀洗涤、灼烧至恒重,所涉及的化学方程式为____________________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,求K+的最小浓度_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com