
【题目】已知某有机物K的合成路线如下所示:
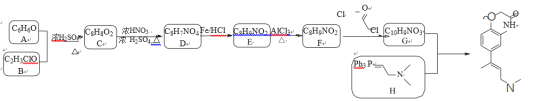
已知:①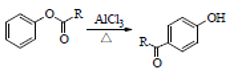
②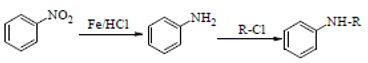
③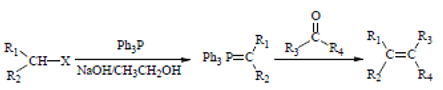
(Ph表示苯基,R、R1、R2、R2、R3表示烃基或氢原子)
(1)下列说法正确的是_________
A.有机物K的分子式为C14H17N2O2
B.可用FeCl3溶液来帮助判断反应E→F是否完全
C.已知RCOCl的性质与酯相似,1mol有机物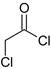 最多能与3molNaOH反应
最多能与3molNaOH反应
D.发生反应E→F,其有机物的水溶性增强
(2)写出有机物B的结构简式_________。
(3)写出F→G的化学方程式_________。
(4)请设计以乙醇和Ph3P为原料合成正丁烷的合成路线_________(用流程图表示,无机试剂任选)。
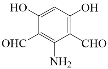
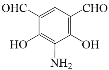
(5)写出化合物D(C8H7NO4)可能的同分异构体的结构简式_________。
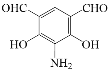
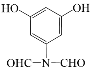
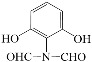
须同时符合:①能使FeCl3溶液显紫色,1mol有机物能与足量银氨溶液反应生成4molAg;②1H-NMR谱显示分子中有4种氢原子;③分子中无N-O键
【答案】CD CH3COCl 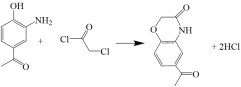

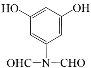
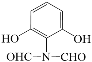
【解析】
A为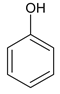 ,B为
,B为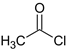 ,在浓硫酸作用下发生取代反应生成C,C为
,在浓硫酸作用下发生取代反应生成C,C为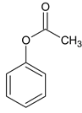 ,C与浓硝酸在浓硫酸加热条件下发生硝化反应生成D,D为
,C与浓硝酸在浓硫酸加热条件下发生硝化反应生成D,D为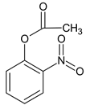 ,D在Fe和HCl作用下,还原生成E,E为
,D在Fe和HCl作用下,还原生成E,E为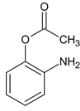 ,根据信息
,根据信息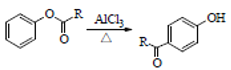 ,E在AlCl3作用下发生重排,得到对位的化合物F,F为
,E在AlCl3作用下发生重排,得到对位的化合物F,F为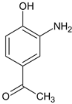 ,F与
,F与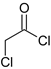 反应生成G,G为
反应生成G,G为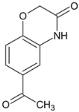 ,根据信息
,根据信息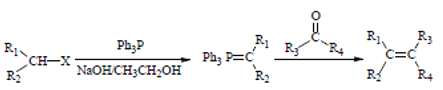 ,G与H反应得到K,K为
,G与H反应得到K,K为 。
。
(1)A.有机物K的分子式为C14H16N2O2,故A错误;
B.可用FeCl3溶液来帮助判断反应E→F是否进行,不能判断反应是否完全,故B错误;
C.已知RCOCl的性质与酯相似, +3NaOH
+3NaOH![]()
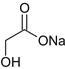 +2NaCl+H2O,1mol有机物
+2NaCl+H2O,1mol有机物 最多能与3molNaOH反应,故C正确;
最多能与3molNaOH反应,故C正确;
D.发生反应E→F,F中含有酚羟基,其有机物的水溶性增强,故D正确;
故答案为:CD;
(2)有机物B的结构简式:CH3COCl。故答案为:CH3COCl
(3)F→G的化学方程式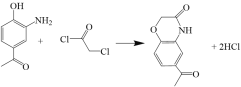 。故答案为:
。故答案为: ;
;
(4)利用信息③,先合成![]() ,再合成CH3CHO,加长碳链,以乙醇和Ph3P为原料合成正丁烷的合成路线:
,再合成CH3CHO,加长碳链,以乙醇和Ph3P为原料合成正丁烷的合成路线: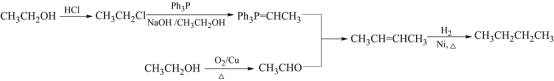 。
。
故答案为: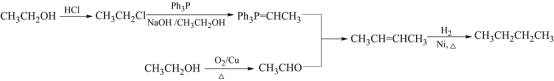 ;
;
(5)化合物D(C8H7NO4)可能的同分异构体的结构简式中同时符合:①能使FeCl3溶液显紫色,说明含有酚羟基,1mol有机物能与足量银氨溶液反应生成4molAg,说明有2个醛基;②1H-NMR谱显示分子中有4种氢原子,分子中有一个对称轴;③分子中无N-O键,符合条件的有: 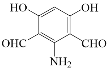
 。
。
故答案为: 



。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】工业制溴的大致流程如图:

已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( )
A. 步骤②通热空气是利用了溴的挥发性
B. 从混合液甲到混合液乙,目的是对溴进行富集
C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1
D. 操作⑤可以采取萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的A为直流电源,B为渗透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
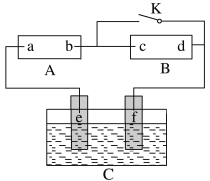
(1)电源A中a点为________极。
(2)滤纸B上发生氧化反应的电极反应方程式为:____________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路:
①电极e上发生的反应为:__________________;
②在此过程中电解液的浓度(填“始终不变”、“略微增大”、“略微减小”)___________;
③电镀槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉可以除去废液中的NaNO3,发生反应的化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为_____________________________。
(2)该反应的还原剂为___________(填化学式,下同),还原产物为_____________。
(3)2.7g铝粉参与反应,溶液的质量增加_________g。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
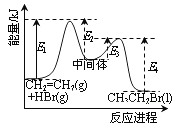
A. 分子式为C2H4O的有机化合物性质相同
B. 同温同压下,同体积的任何气体均含有相同的原子数
C. 密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023
D. 依据右图能量曲线可确定反应:CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的![]() H= (E1+E3-E2-E4)kJ·mol-1
H= (E1+E3-E2-E4)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50℃时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
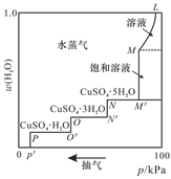
A.曲线L-M对应溶液中无硫酸铜晶体析出
B.曲线M-M对应溶液溶质的质量分数保持不变
C.曲线M- N对应体系存在平衡:CuSO4(饱和溶液)![]() CuSO4·5H2O(s)+H2O(g)
CuSO4·5H2O(s)+H2O(g)
D.当容器中压强低于p后得到无水硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂。某研发小组通过下列流程制备碱式次氯酸镁:
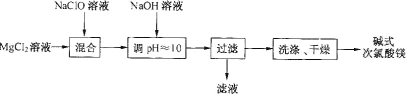
(1)从上述流程中可以判断,滤液中可回收的主要物质是__________。
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式:_____。
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:ClO-+Cl-+2H+=Cl2↑+H2O![]() ,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
,若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。
①通过计算判断该产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)_____________
②根据你的判断,推测产品中可能含有的杂质,并给出制备过程能减少产品中含有该杂质的措施_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com