
【题目】工业制溴的大致流程如图:

已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( )
A. 步骤②通热空气是利用了溴的挥发性
B. 从混合液甲到混合液乙,目的是对溴进行富集
C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1
D. 操作⑤可以采取萃取、分液、蒸馏
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、G是金属单质,F是一种难溶于水的白色化合物,受热后容易发生分解。
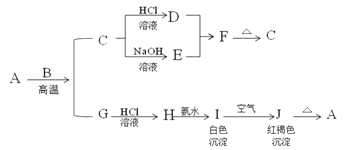
(1)写出下列物质的化学式:A:___ E:___ F:___ H:__。
(2)按要求写方程式:
①H与氨水反应的离子方程式:___。
②B与氢氧化钠溶液反应的离子方程式:___。
③I在空气中转化为J的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0mol·L-1的NaOH溶液480mL。
(1)配制时,必须使用的玻璃仪器有___。
(2)要完成本实验该同学应称出NaOH__g。
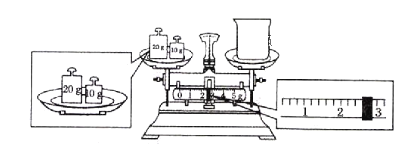
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为__g。(砝码一个20克、一个10克)
(4)使用容量瓶前必须进行的一步操作是__。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__。
①没有洗涤烧杯和玻璃棒
②定容时俯视刻度线
③未冷却到室温就将溶液转移到容量瓶并定容
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,是大气的重要污染源之一。用Ca(ClO)2溶液对烟气[n(SO2) ∶n(NO) =3∶2]同时脱硫脱硝(分别生成SO42-、NO3-),得到NO、SO2脱除率如下图,下列说法不正确的是

A.脱除NO的反应:2NO+3ClO-+H2O=2H++2NO3- +3Cl-
B.SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO
C.依据图中信息,在80 min时,吸收液中n(NO3-)∶n(Cl-)=2∶3
D.随着脱除反应的进行,吸收剂溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
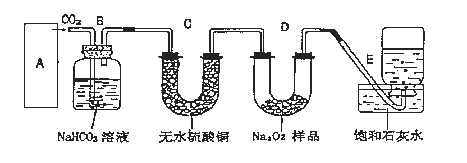
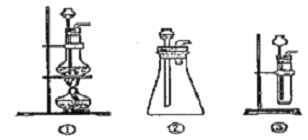
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:___。
B装置的作用是___,C装置内可能出现的现象是___。为了检验E中收集到的气体,在取出集气瓶后,检验方法是___。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:___。(用离子反应方程式表示)。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为260mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值___(答大或小),相差___mL(取整数值,所用数据均在标准状况下测定),这是由于____。
(4)你认为上述A-E的实验装置中,E部分是否安全、合理?___(答是或否),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L三氯甲烷中含氢原子数为0.1 NA
B.0.1mo1L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA
C.8.0gNH4NO3发生反应5NH4NO3= 4N2+2HNO3+9H2O,转移电子数为0.3 NA
D.0.1mo1P35Cl3与足量37Cl2发生反应:PCl3+Cl2![]() PCl5,产物中P—37Cl键数为0.2 NA
PCl5,产物中P—37Cl键数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学碘硫循环可用于大规模制氢气,HI分解和SO2水溶液还原I2均是其中的主要反应。回答下列问题:
(1)碘硫热化学循环中,SO2的水溶液还原I2的反应包括:SO2+I2+2H2O![]() 3H++HSO4- +2I- 、I-+I2
3H++HSO4- +2I- 、I-+I2![]() I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(
I3-。若起始时n(I2)=n(SO2)=1mo1,I- 、I3- 、H+ 、HSO4-的物质的量随(![]() )的变化如图所示:
)的变化如图所示:
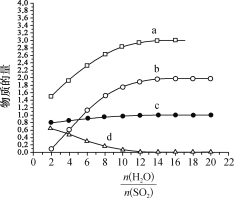
图中表示的微粒:a为_____________,d为____________________。
(2)起始时 HI的物质的量为1mo1,总压强为0.1MPa下,发生反应 HI(g) ![]()
![]() H2(g)+
H2(g)+![]() I2(g) 平衡时各物质的物质的量随温度变化如图所示:
I2(g) 平衡时各物质的物质的量随温度变化如图所示:
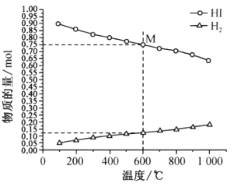
①该反应的△H __________________ (“>”或“<”)0。
②600℃时,平衡分压p(I2)= ______MPa,反应的平衡常数Kp=_____________ (Kp为以分压表示的平衡常数)。
(3)反应 H2(g)+I2(g) ![]() 2HI(g)的反应机理如下:
2HI(g)的反应机理如下:
第一步:I2![]() 2I(快速平衡)
2I(快速平衡)
第二步:I+H2![]() H2I(快速平衡)
H2I(快速平衡)
第三步:H2I+I ![]() 2HI (慢反应)
2HI (慢反应)
①第一步反应_____________ (填 “放出”或“吸收”)能量。
②只需一步完成的反应称为基元反应,基元反应如aA+dD = gG+hH 的速率方程,v= kca(A)cd(D),k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。H2(g)与I2(g)反应生成 HI(g)的速率方程为v= ________(用含k1、k-1、k2…的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
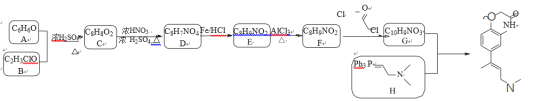
【题目】已知某有机物K的合成路线如下所示:
已知:①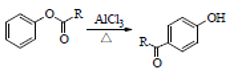
②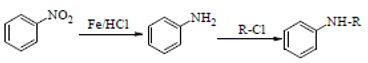
③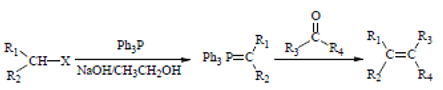
(Ph表示苯基,R、R1、R2、R2、R3表示烃基或氢原子)
(1)下列说法正确的是_________
A.有机物K的分子式为C14H17N2O2
B.可用FeCl3溶液来帮助判断反应E→F是否完全
C.已知RCOCl的性质与酯相似,1mol有机物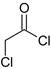 最多能与3molNaOH反应
最多能与3molNaOH反应
D.发生反应E→F,其有机物的水溶性增强
(2)写出有机物B的结构简式_________。
(3)写出F→G的化学方程式_________。
(4)请设计以乙醇和Ph3P为原料合成正丁烷的合成路线_________(用流程图表示,无机试剂任选)。
(5)写出化合物D(C8H7NO4)可能的同分异构体的结构简式_________。
须同时符合:①能使FeCl3溶液显紫色,1mol有机物能与足量银氨溶液反应生成4molAg;②1H-NMR谱显示分子中有4种氢原子;③分子中无N-O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com