
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L三氯甲烷中含氢原子数为0.1 NA
B.0.1mo1L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA
C.8.0gNH4NO3发生反应5NH4NO3= 4N2+2HNO3+9H2O,转移电子数为0.3 NA
D.0.1mo1P35Cl3与足量37Cl2发生反应:PCl3+Cl2![]() PCl5,产物中P—37Cl键数为0.2 NA
PCl5,产物中P—37Cl键数为0.2 NA
科目:高中化学 来源: 题型:
【题目】旋烷是一类比较特殊的碳氢化合物,其张力较大。如下给出了几种旋烷的结构。下列说法不正确的是( )
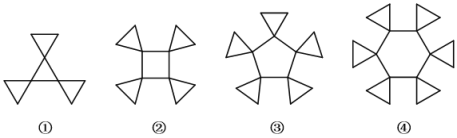
A.旋烷①与三甲苯互为同分异构体
B.旋烷②的二氯代物种类数小于其十四氯代物的种类数
C.1 mol旋烷③完全燃烧时消耗20 mol O2,生成10 mol H2O
D.旋烷系列分子中含碳量为0. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制溴的大致流程如图:

已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( )
A. 步骤②通热空气是利用了溴的挥发性
B. 从混合液甲到混合液乙,目的是对溴进行富集
C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1
D. 操作⑤可以采取萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比,过程如下:
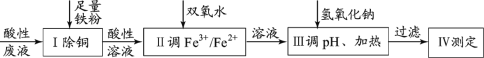
已知: 25℃时:Ksp[Fe(OH)2]=8.0×10–16;溶解度S( FeCl2 )=64g。
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调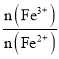 比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
(3)过程Ⅲ:调pH、加热
(i)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
(ii)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会掺杂较多红棕色杂质,试分析可能的原因__________。
(iii)丙同学迅速将溶液调节pH=9,在80~90℃下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol/L KMnO4标准液滴定。(已知:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(5)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在有机合成中用途广泛,工业制备碘化钠有多种方法,下图是制备碘化钠的两种方案。已知:3I2+6NaOH=5NaI+NaIO3+3H2O;N2H4·H2O的沸点118℃,100℃开始分解。
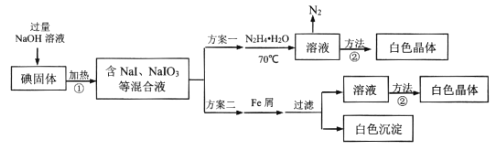
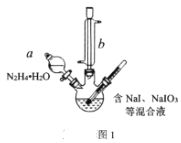
(1)方案一中加入N2H4·H2O后发生的离子反应为:2IO3-(aq)+3N2H4·H2O(l)=2I-(aq)+3N2(g)+7H2O(l) △H<0;部分装置如图1所示。
①图1中仪器b的名称为___。若要使分液漏斗中的液体流入三颈烧瓶中,具体的操作是___。
②实验过程中需控制反应温度70℃左右的原因是___。图1中加热的方式最好选用____。
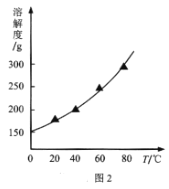
(2)结合NaI溶解度曲线(如图2),流程图中方法②的具体操作为:加热蒸发、___、过滤、洗涤得到白色晶体。
(3)写出方案二中加入Fe屑后的离子方程式_____。
(4)方案二比方案一得到产品的产率略低,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子式为C2H4O的有机化合物性质相同
B. 同温同压下,同体积的任何气体均含有相同的原子数
C. 密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023
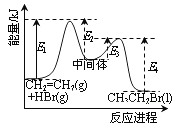
D. 依据右图能量曲线可确定反应:CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的![]() H= (E1+E3-E2-E4)kJ·mol-1
H= (E1+E3-E2-E4)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com