
【题目】某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比,过程如下:
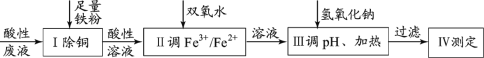
已知: 25℃时:Ksp[Fe(OH)2]=8.0×10–16;溶解度S( FeCl2 )=64g。
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调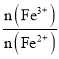 比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
(3)过程Ⅲ:调pH、加热
(i)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
(ii)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会掺杂较多红棕色杂质,试分析可能的原因__________。
(iii)丙同学迅速将溶液调节pH=9,在80~90℃下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol/L KMnO4标准液滴定。(已知:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(5)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
【答案】Fe+Cu2+=Fe2++Cu Fe3+催化,使H2O2分解放出氧气 加入铁氰化钾溶液,出现蓝色沉淀 Ksp[Fe(OH)2]=8.0×10–16,pH=4时,生成Fe(OH)2沉淀所需c(Fe2+)>8×104 mol/L,根据氯化亚铁溶解度,溶液中亚铁离子浓度不可能达到 4Fe2++O2+6H2O=4FeO(OH) +8H+ pH过高(pH>9)、温度高于95oC,Fe(OH)2还原性增强,与空气中氧气反应速率加快,使Fe(OH)3增加过多,Fe(OH)3分解成红棕色Fe2O3 Fe2++2Fe3++8OH-![]() Fe3O4↓+4H2O
Fe3O4↓+4H2O ![]()
【解析】
印刷电路板回收液的pH=1,含Fe2+、Cu2+、Cl-及H+和少量Fe3+,由于微粒的氧化性:Fe3+>Cu2+>H+>Fe2+,向其中加入足量的Fe粉,会先后发生反应:2Fe3++Fe=3Fe2+;Fe+Cu2+=Fe2++Cu;Fe+2H+=Fe2++H2↑.然后过滤除去过量的Fe及产生的Cu,向滤液中加入双氧水,发生反应:2Fe2++H2O2+2H+=2Fe3++2H2O,调整溶液中Fe3+与Fe2+的物质的量的比,使n(Fe3+):n(Fe2+)=1.6:1,然后向溶液中加入NaOH溶液,调整溶液pH,发生反应产生Fe3O4和H2O,过滤得到磁性氧化铁。
(1)过程Ⅰ中Fe与Cu2+发生置换反应产生Cu单质与Fe2+,所以过程Ⅰ中除铜反应的离子方程式为Fe+Cu2+=Fe2++Cu;
(2)过程Ⅱ中加入H2O2,发生氧化还原反应:2Fe2++H2O2+2H+=2Fe3++2H2O,调n(Fe3+):n(Fe2+)比为1.6:1,在此过程中有少量无色气体生成,该气体为O2,这是由于Fe3+具有催化作用,能够使H2O2分解放出O2;
(3)(i)①取静置后的上层清液,向其中加入K3[Fe(CN)6]溶液,若产生蓝色沉淀,就证明该溶液中含有Fe2+;
②pH≈4时,c(H+)=10-4 mol/L,则溶液中c(OH-)=![]() mol/L=10-10 mol/L,由于在25℃时:Ksp[Fe(OH)2]=8.0×10–16,则要形成Fe(OH)2沉淀,需要Fe2+的最小浓度为c(Fe2+)>
mol/L=10-10 mol/L,由于在25℃时:Ksp[Fe(OH)2]=8.0×10–16,则要形成Fe(OH)2沉淀,需要Fe2+的最小浓度为c(Fe2+)>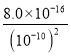 =8.0×104 mol/L,根据氯化亚铁溶解度,S(FeCl2)=64g,则溶液中亚铁离子浓度不可能达到,因此沉淀中一定不含有Fe(OH)2;
=8.0×104 mol/L,根据氯化亚铁溶解度,S(FeCl2)=64g,则溶液中亚铁离子浓度不可能达到,因此沉淀中一定不含有Fe(OH)2;
(ii)①若调节pH过程太慢,在溶液pH≈5时,Fe2+容易被溶解在溶液中的O2氧化生成FeO(OH)固体影响产品质量,发生反应的离子方程式为:4Fe2++O2+6H2O=4FeO(OH) +8H+;
②若其它条件不变,调节pH过高,如溶液pH>9、温度高于95oC,Fe(OH)2还原性增强,与空气中氧气反应速率加快,使Fe(OH)3增加过多,Fe(OH)3受热分解产生红棕色Fe2O3,使产品中混有较多红棕色杂质;
(iii)迅速将溶液调节pH=9,在80~90℃下搅拌2小时,发生反应:Fe2++2Fe3++8OH-![]() Fe3O4↓+4H2O,然后过滤、洗涤、干燥得到晶体产品;
Fe3O4↓+4H2O,然后过滤、洗涤、干燥得到晶体产品;
(4)取产品样品a g,加过量硫酸溶解,发生反应:Fe3O4+8H+=Fe2++2Fe3++4H2O,得到样品溶液,然后用col/LKMnO4标准液滴定,发生MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
i.取v0mL样品溶液,用标准液滴定至终点,消耗标准液v1mL,n(KMnO4)=c·V=c mol/L×v1×10-3 L=cv1×10-3 mol;则n(Fe2+)=5n(KMnO4)=5cv1×10-3 mol;
ii.另取v0mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2mL,则反应后溶液中Fe2+总物质的量为n(Fe2+)=5n(KMnO4)总=5cv2×10-3 mol;原溶液中Fe3+的物质的量为n(Fe3+)=5cv2×10-3 mol-5cv1×10-3 mol=5c(v2-v1)×10-3 mol。
(5)晶体中Fe3+和Fe2+的物质的量比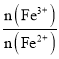 =
=![]() =
=![]() 。
。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】锆石(ZrSiO4)酷似钻石且价格低廉,是钻石很好的代用品。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如下:
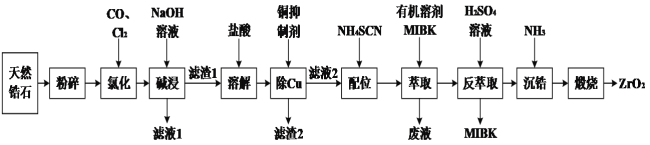
已知:i.氯化过程中除C、O外,其他元素均转化为其最高价氯化物;
ⅱ.Zr在化合物中通常显+4价;ZrC14易溶于水,400 ℃时升华;
ⅲ.“配合”生成的Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)将锆石“粉碎”的目的是_______________________________。
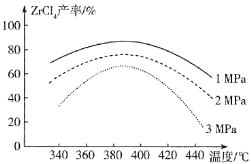
(2)“氯化”过程中,ZrSiO4发生反应的化学方程式为_______________,由下图可知,“氯化”过程选择的最佳反应条件是_________ ;若“氯化”温度过高会导致ZrC14产率降低,原因是________。
(3)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2,其Ksp=4.0×10-10。已知盐酸溶解后的溶液中Cu2+的浓度为1mol·L-1,若溶液中Cu2+的浓度小于等于1.0×10-6mol·L-1时可视为沉淀完全,则Cu2+沉淀完全时溶液中CN-的浓度为________molL-1。
(4)由于NaCN有剧毒,所以需要对“废液”中的NaCN进行处理,通常选用漂白液(有效成分是NaClO)在碱性条件下将其氧化,其产物之一是空气中的主要成分,则上述反应的离子方程式为___________。
(5)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,是大气的重要污染源之一。用Ca(ClO)2溶液对烟气[n(SO2) ∶n(NO) =3∶2]同时脱硫脱硝(分别生成SO42-、NO3-),得到NO、SO2脱除率如下图,下列说法不正确的是

A.脱除NO的反应:2NO+3ClO-+H2O=2H++2NO3- +3Cl-
B.SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO
C.依据图中信息,在80 min时,吸收液中n(NO3-)∶n(Cl-)=2∶3
D.随着脱除反应的进行,吸收剂溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA
B.7gCnH2n中含有的氢原子数目为NA
C.任何气体单质在标况下体积若为22.4L,则含有2NA个原子
D.1molNa2O2与水反应转移的电子数约为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L三氯甲烷中含氢原子数为0.1 NA
B.0.1mo1L-1 Na2SO3溶液中,含硫元素的粒子数目之和为0.1NA
C.8.0gNH4NO3发生反应5NH4NO3= 4N2+2HNO3+9H2O,转移电子数为0.3 NA
D.0.1mo1P35Cl3与足量37Cl2发生反应:PCl3+Cl2![]() PCl5,产物中P—37Cl键数为0.2 NA
PCl5,产物中P—37Cl键数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼烯是继石墨烯之后又一种“神奇纳米材料”,具有优良的导电、导热性能。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法正确的是

A.“皱褶”式硼烯中含B、H 两种元素
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼的最高价氧化物对应水化物的酸性比碳酸的强
D.硼烯有望代替石墨烯作锂离子电池的电极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是

A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取 30.8g 甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A 和混合气体 B;若相同质量的甲酸铜在空气中充分加热,则生成黑色固体 D 和 CO2、H2O。固体 A 和 D 质量相差 2.4g。则:
(1)红色固体 A 中 Cu 单质的物质的量为_________mol。
(2)将混合气体B 置于O2 中充分燃烧,消耗 O2 的体积是_________L (换算为标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com