
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是

A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】化合物I(4-对羟基苯基-2-丁酮)是国际公认的既安全又获广泛应用的合成香料。由化合物A制备I的一种合成路线如下:

回答下列问题:
(1)A的化学名称为________________。
(2)B中的官能团名称是_________________。
(3)F的结构简式为_______________。
(4)⑤的反应类型是________________。
(5)写出满足下列条件的G的同分异构体的结构简式:______________。
i.属于芳香族化合物;
ii.既能发生银镜反应,又能发生水解反应;
iii.核磁共振氢谱为三组峰,峰面积比为6︰2︰1。
(6)设计由氯乙烷和丙二酸制备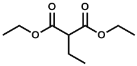 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比,过程如下:
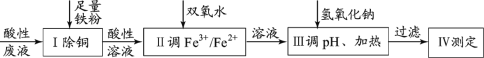
已知: 25℃时:Ksp[Fe(OH)2]=8.0×10–16;溶解度S( FeCl2 )=64g。
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调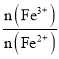 比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
(3)过程Ⅲ:调pH、加热
(i)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
(ii)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会掺杂较多红棕色杂质,试分析可能的原因__________。
(iii)丙同学迅速将溶液调节pH=9,在80~90℃下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol/L KMnO4标准液滴定。(已知:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(5)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E都含另外同一种元素。请回答:
(1)A是__________,Y是__________,Z是__________。
(2)当X是强酸时,E是__________;B生成C的化学方程式是________________________。
(3)当X是强碱时,E是__________; B生成C的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com