
【题目】取 30.8g 甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A 和混合气体 B;若相同质量的甲酸铜在空气中充分加热,则生成黑色固体 D 和 CO2、H2O。固体 A 和 D 质量相差 2.4g。则:
(1)红色固体 A 中 Cu 单质的物质的量为_________mol。
(2)将混合气体B 置于O2 中充分燃烧,消耗 O2 的体积是_________L (换算为标准状况)。
【答案】0.1 2.8
【解析】
(1)n[(HCOO)2Cu]=![]() =0.2mol,在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A,设Cu的物质的量为x,Cu2O的物质的量为y,x+y=0.2mol,在空气中加热生成CuO,增加2.4g,x+y=
=0.2mol,在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A,设Cu的物质的量为x,Cu2O的物质的量为y,x+y=0.2mol,在空气中加热生成CuO,增加2.4g,x+y=![]() =0.15mol,解得x=0.1mol,y=0.05mol,故答案为:0.1;
=0.15mol,解得x=0.1mol,y=0.05mol,故答案为:0.1;
(2)由(1)甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A ,A中Cu的物质的量:Cu2O的物质的量=0.1mol:0.05mol=2:1,则(HCOO)2Cu分解的方程式为:4(HCOO)2Cu![]() 2Cu+Cu2O+4H2O+5CO+3CO2,0.2mol(HCOO)2Cu分解生成n(CO)=
2Cu+Cu2O+4H2O+5CO+3CO2,0.2mol(HCOO)2Cu分解生成n(CO)=![]() ×0.2mol=0.25mol,置于O2 中充分燃烧,消耗 O2 的体积是0.25mol×
×0.2mol=0.25mol,置于O2 中充分燃烧,消耗 O2 的体积是0.25mol×![]() ×22.4L·mol-1=2.8L,故答案为:2.8。
×22.4L·mol-1=2.8L,故答案为:2.8。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比,过程如下:
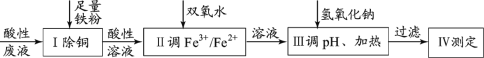
已知: 25℃时:Ksp[Fe(OH)2]=8.0×10–16;溶解度S( FeCl2 )=64g。
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调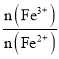 比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
比为1.6:1。该过程中有少量无色气体生成,主要原因是______。
(3)过程Ⅲ:调pH、加热
(i)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
(ii)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会掺杂较多红棕色杂质,试分析可能的原因__________。
(iii)丙同学迅速将溶液调节pH=9,在80~90℃下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol/L KMnO4标准液滴定。(已知:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(5)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E都含另外同一种元素。请回答:
(1)A是__________,Y是__________,Z是__________。
(2)当X是强酸时,E是__________;B生成C的化学方程式是________________________。
(3)当X是强碱时,E是__________; B生成C的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A. ①② B. ④ C. ③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
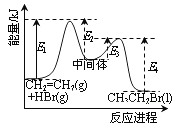
A. 分子式为C2H4O的有机化合物性质相同
B. 同温同压下,同体积的任何气体均含有相同的原子数
C. 密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023
D. 依据右图能量曲线可确定反应:CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的![]() H= (E1+E3-E2-E4)kJ·mol-1
H= (E1+E3-E2-E4)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
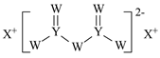
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A为一种黄绿色的气体,B为常见的无色液体,H为一种助燃的气体,F为一种气体,它在A中燃烧产生苍白色火焰,E为一种能被磁铁吸引的金属。
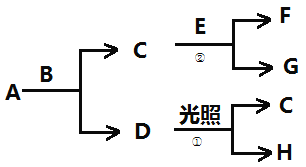
(1)B的化学式为____________。
(2)F的化学式为____________。
(3)写出反应②的化学方程式:_______________________________。
(4)写出反应①的化学方程式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com