
【题目】W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
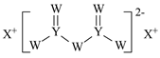
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
【答案】B
【解析】
X是短周期原子半径最大的元素,则X为Na;根据W、X、Y三种元素形成的化合物可知,Y可以形成4个共价键,且Y的最高化合价与最低价相加为0,应为第ⅣA族元素,其原子序数大于Na,则为Si元素;W可以形成2个共价键,应为第ⅥA族元素,其原子序数小于Na,所以为O元素,Z是同周期非金属性最强的元素,其原子序数大于Si,则应为Cl元素。
A.X单质为Na,为金属晶体,而Y的单质Si为原子晶体,熔点高于Na,故A错误;
B.非金属性越强,气态氢化物的稳定性越强,非金属性Cl>Si,所以气态氢化物稳定性Cl>Si,故B正确;
C.Z的氧化物对应的水化物有多种,例如HClO即为弱酸,故C错误;
D.Na与Cl形成的二元化合物NaCl水溶液显中性,故D错误;
故答案为B。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】硼烯是继石墨烯之后又一种“神奇纳米材料”,具有优良的导电、导热性能。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法正确的是

A.“皱褶”式硼烯中含B、H 两种元素
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼的最高价氧化物对应水化物的酸性比碳酸的强
D.硼烯有望代替石墨烯作锂离子电池的电极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO (g)+H2O (g) ![]() CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:
CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:

下列说法正确的是
A.0~5 min 用 CO 表示的平均反应速率为 0.08mol·L1·min1
B.该反应在 10 min 后才达到平衡
C.温度升高至 800℃时,反应平衡常数为 0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取 30.8g 甲酸铜[(HCOO)2Cu]在隔绝空气的条件下加热分解,会生成含两种红色固体的混合物 A 和混合气体 B;若相同质量的甲酸铜在空气中充分加热,则生成黑色固体 D 和 CO2、H2O。固体 A 和 D 质量相差 2.4g。则:
(1)红色固体 A 中 Cu 单质的物质的量为_________mol。
(2)将混合气体B 置于O2 中充分燃烧,消耗 O2 的体积是_________L (换算为标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一压强始终与外界大气压相同的密闭容器中,将适量硫粉和碳粉的混合物与一定量的O2完全反应,恢复到常温,放出504.875kJ的热量,反应后O2有剩余。在标准状况下测得反应后混合气体的体积为44.8L,已知反应后的混合气体中某种气体(A)的质量与物质的量均为另两种气体之和,且C(s)+O2(g) = CO2(g) ΔH=-393.5kJ/mol-1。
(1)投入O2的总体积在标准状况下的体积为____________L。
(2)A为_________。
A.SO2 B.CO2 C.O2 D.无法确定
(3)反应后混合气体的平均摩尔质量为__________________。
(4)混合气体中![]() =_____________。
=_____________。
(5)表示硫燃烧热的热化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2 ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
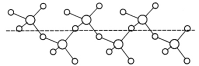
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
(4)绿矾是一种重要的硫酸盐,其组成可写成[Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42-中的O原子相联结,按图示画出含氢键的水合阴离子:______________。

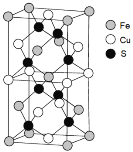
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成F,其合成路线如下图所示。

(1)A分子中官能团的名称是____________,D中官能团的名称是________反应①的反应类型是___________反应。
(2)反应②的化学方程式是___________________________。
反应④的化学方程式是___________________________。
(3)E是常见的高分子材料,合成E的化学方程式是_____________________________。

(4)某同学用如右图所示的实验装置制取少量F。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
① 实验开始时,试管甲中的导管不伸入液面下的原因是______________。
②上述实验中饱和碳酸钠溶液的作用是(填字母) ________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备F的实验中,若用1mol B和1mol D充分反应,__________(能/不能)生成1mol F,原因是 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)![]() 的系统命名____。
的系统命名____。
(2)2,5-二甲基-2,4-己二烯的结构简式:___。
(3)![]() 的键线式:____。
的键线式:____。
(4)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为____。
(5)有机物二苯甲烷![]() 中,该分子中有__种不同化学环境的H原子。
中,该分子中有__种不同化学环境的H原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com