
【题目】A是一种红棕色金属氧化物,B、G是金属单质,F是一种难溶于水的白色化合物,受热后容易发生分解。
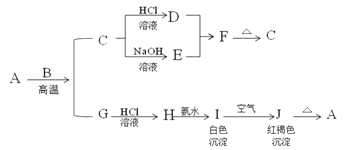
(1)写出下列物质的化学式:A:___ E:___ F:___ H:__。
(2)按要求写方程式:
①H与氨水反应的离子方程式:___。
②B与氢氧化钠溶液反应的离子方程式:___。
③I在空气中转化为J的化学方程式:___。
【答案】Fe2O3 NaAlO2 Al(OH)3 FeCl2 Fe2+ +2NH3·H2O=Fe(OH)2↓+2NH4+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以J是氢氧化铁,I是氢氧化亚铁,根据物质的性质可推断得,H是氯化亚铁,G是金属铁,F是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,D是氯化铝,E是偏铝酸钠,根据铁及化合物以及铝及化合物的有关性质来回答.
(1)根据分析可知A为Fe2O3;E为NaAlO2;F为Al(OH)3;H为FeCl2,
故答案为:Fe2O3;NaAlO2; Al(OH)3;FeCl2;
(2)①FeCl2与氨水反应的离子方程式为Fe2+ +2NH3·H2O=Fe(OH)2↓+2NH4+;
②铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
③氢氧化亚铁在空气中转化为氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:Fe2+ +2NH3·H2O=Fe(OH)2↓+2NH4+;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
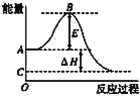
(1)图中A、C分别表示____,___,E的大小对该反应的反应热__(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___(填“升高”或“降低”),ΔH___(填“变大”“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:_____。
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量:_____。
③在25℃、101kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】旋烷是一类比较特殊的碳氢化合物,其张力较大。如下给出了几种旋烷的结构。下列说法不正确的是( )
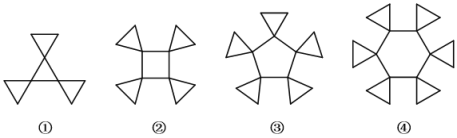
A.旋烷①与三甲苯互为同分异构体
B.旋烷②的二氯代物种类数小于其十四氯代物的种类数
C.1 mol旋烷③完全燃烧时消耗20 mol O2,生成10 mol H2O
D.旋烷系列分子中含碳量为0. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的化工产品,它在纺织、印染、医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
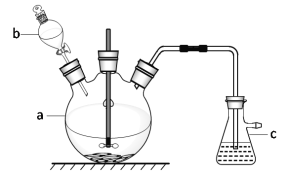
①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热。
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为_______;将仪器b中液体滴入仪器a中的具体操作是_____________。
(2)写出仪器a中反应的化学方程式:________________。
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是____________________。
(4)为提高尾气吸收,防止空气污染,下列装置___________(填字母)适合吸收逸出的气体(反应中产生的气体因来不及被石灰乳吸收而逸出)。
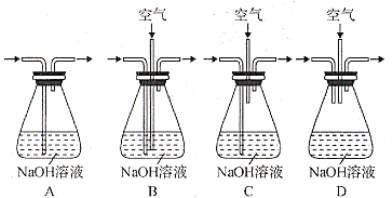
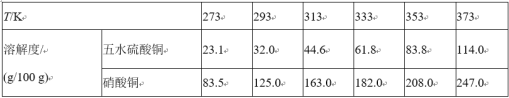
(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:_________。除去硫酸铜晶体中的少量硝酸铜可采用____________方法,检验硝酸铜是否被除净的方法:_____________。
(6)本实验采用硝酸氧化法制取硫酸铜,工业上也常采用将铜在450 ℃左右焙烧,再与一定浓度的硫酸反应制取硫酸铜的方法。采用硝酸氧化法的优点在于__________________。
(7)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成 100 mL 溶液,每次取 20. 00 mL,用 c mol L-1 EDTA (H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。 滴定反应为Cu2++ H2Y2-→CuY2-+2H+。计算蓝色晶体中Cu2+质量分数w=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(4-对羟基苯基-2-丁酮)是国际公认的既安全又获广泛应用的合成香料。由化合物A制备I的一种合成路线如下:

回答下列问题:
(1)A的化学名称为________________。
(2)B中的官能团名称是_________________。
(3)F的结构简式为_______________。
(4)⑤的反应类型是________________。
(5)写出满足下列条件的G的同分异构体的结构简式:______________。
i.属于芳香族化合物;
ii.既能发生银镜反应,又能发生水解反应;
iii.核磁共振氢谱为三组峰,峰面积比为6︰2︰1。
(6)设计由氯乙烷和丙二酸制备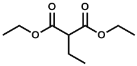 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 以
以![]() (体积比)分别通入到体积为2L的恒容密闭容器中进行反应:
(体积比)分别通入到体积为2L的恒容密闭容器中进行反应:![]() ,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
实验 | 温度/℃ | 起始 | 平衡 | 达平衡所需时间/min |
① | 500 | 5.00 | 2.00 | 40 |
② | 800 | 3.00 | 1.00 | 15 |
③ | 500 | 3.00 | 1.20 | 9 |
A. 实验①中,在![]() 内,以
内,以![]() 表示的反应速率大于
表示的反应速率大于![]()
B. 比较实验①和②,不能说明浓度对反应速率的影响
C. 比较实验①和②,不能说明反应速率随温度升高而增大
D. 比较实验②和③,说明实验③使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制溴的大致流程如图:

已知溴的沸点为58.7℃,常温下在水中的溶解度为3.58g;溴与碳酸钠溶液反应生成NaBr、NaBrO3、CO2等。则下列理解不正确的是( )
A. 步骤②通热空气是利用了溴的挥发性
B. 从混合液甲到混合液乙,目的是对溴进行富集
C. 步骤④加硫酸后发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为1:1
D. 操作⑤可以采取萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com