
【题目】铝粉可以除去废液中的NaNO3,发生反应的化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为_____________________________。
(2)该反应的还原剂为___________(填化学式,下同),还原产物为_____________。
(3)2.7g铝粉参与反应,溶液的质量增加_________g。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明____________。
【答案】10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O Al N2 1.86 Al2O3熔点高
【解析】
(1)NaNO3、NaOH、NaAlO2都是易溶于水的强电解质,书写离子方程式时,将它们改写为离子,然后删去两边未参加反应的离子。
(2)该反应的还原剂为含化合价升高元素的反应物,还原产物为含化合价降低元素的生成物。
(3)2.7g铝粉参与反应,溶液的质量增加应为铝的质量与NO质量之差。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明铝的熔化温度比氧化铝的熔化温度低。
(1)将化学方程式10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中的NaNO3、NaOH、NaAlO2改写为离子,即得10Al+6Na++6NO3-+4Na++4OH-=10Na++10AlO2-+3N2↑+2H2O,然后删去两边未参加反应的Na+,即得离子方程式为10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。答案为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;
(2)10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中,还原剂为Al,还原产物为N2。答案为:Al;N2;
(3)设溶液的质量增加为x
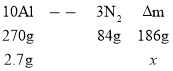
由观察可得出,x=1.86g。答案为:1.86。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明铝的熔化温度比氧化铝的熔化温度低。答案为:Al2O3熔点高。


科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用,它与二氧化碳反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
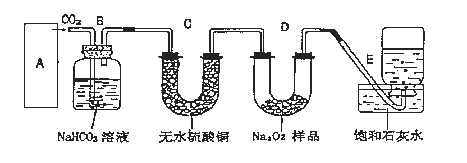
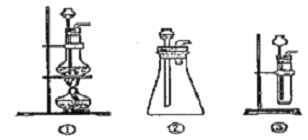
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:___。
B装置的作用是___,C装置内可能出现的现象是___。为了检验E中收集到的气体,在取出集气瓶后,检验方法是___。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因:___。(用离子反应方程式表示)。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为260mL,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值___(答大或小),相差___mL(取整数值,所用数据均在标准状况下测定),这是由于____。
(4)你认为上述A-E的实验装置中,E部分是否安全、合理?___(答是或否),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池由于具有较高的比能量而成为未来电动汽车的希望。其原理模型如图所示,下列说法不正确的是

A. 可以用LiOH溶液做电解质溶液
B. 锂既是负极材料又是负极反应物
C. 正极反应为2Li+ + O2 + 2e- ![]() Li2O2
Li2O2
D. 正极采用多孔碳材料是为了更好的吸附空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中阴极产物为:_____________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为:_________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。


图2电池负极区的电极反应为:_______________;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为____________________,若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是___________(填A或B)电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物K的合成路线如下所示:
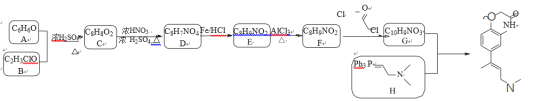
已知:①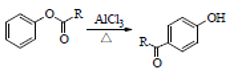
②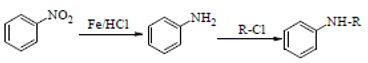
③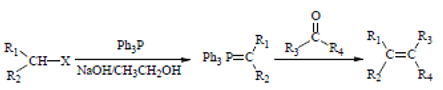
(Ph表示苯基,R、R1、R2、R2、R3表示烃基或氢原子)
(1)下列说法正确的是_________
A.有机物K的分子式为C14H17N2O2
B.可用FeCl3溶液来帮助判断反应E→F是否完全
C.已知RCOCl的性质与酯相似,1mol有机物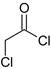 最多能与3molNaOH反应
最多能与3molNaOH反应
D.发生反应E→F,其有机物的水溶性增强
(2)写出有机物B的结构简式_________。
(3)写出F→G的化学方程式_________。
(4)请设计以乙醇和Ph3P为原料合成正丁烷的合成路线_________(用流程图表示,无机试剂任选)。
(5)写出化合物D(C8H7NO4)可能的同分异构体的结构简式_________。
须同时符合:①能使FeCl3溶液显紫色,1mol有机物能与足量银氨溶液反应生成4molAg;②1H-NMR谱显示分子中有4种氢原子;③分子中无N-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18g碳单质与标准状况下22.4LO2反应放出热量是Q1kJ,已知由碳单质生成1molCO2气体放热Q2kJ。下列说法不正确的是( )
A. 由碳燃烧生成CO的热化学方程式是C(s)+1/2O2(g)=CO(g) △H=(Q1-0.5Q2)kJ/mol
B. 由碳燃烧生成1molCO放出的热量是(Q1-0.5Q2)kJ
C. 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)=2CO(g) △H=(Q2-2Q1)kJ/mol
D. 碳和CO2反应的热化学方程式是C(s)+CO2(g)=2CO(g) △H=(2Q2-2Q1)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+
已知该反应的速率随c(H+)的增大而加快。下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是
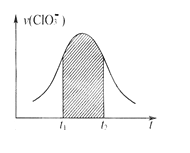
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 纵坐标为v(H+)的v-t曲线与图中曲线完全重合
D. 后期反应速率下降的主要原因是反应物浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】腈亚胺与邻酚羟基苄醇在碱的作用下可以发生偶联反应生成醚键,反应的条件温和,操作简单,目标产物收率高。下面是利用该方法合成化合物H的一种方法:
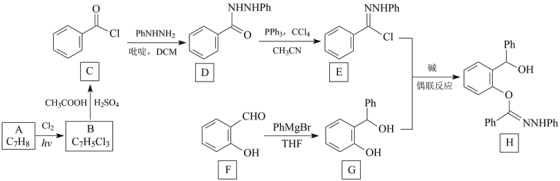
注:以上合成路线中,Ph代表苯基,如PhNHNH2表示![]() 。
。
实验 | 碱 | 温度/℃ | 溶剂 | 产率% |
1 | Et3N | 25 | DCM | <10 |
2 | 吡啶 | 25 | DCM | <5 |
3 | Cs2CO3 | 25 | DCM | 70 |
4 | LiOtBu | 25 | DCM | 43 |
5 | Cs2CO3 | 25 | DMF | 79 |
6 | Cs2CO3 | 25 | CH3CN | 83 |
回答下列问题:
(1)A的化学名称为_________,B的结构简式为___________。
(2)由C生成D的反应类型是________,F中的官能团名称是___________。
(3)H的分子式为_______________。
(4)不同条件对偶联反应生成H产率的影响如上表:
观察上表可知,当选用DCM作溶剂时,最适宜的碱是____________,由实验3、实验4和实验5可得出的结论是:25℃时,____________________,H产率最高。
(5)X为G的同分异构体,写出满足下列条件的X的结构简式:____________。
①所含苯环个数与G相同;②有四种不同化学环境的氢,其个数比为1:1:2:2
(6)利用偶联反应,以![]() 和化合物D为原料制备
和化合物D为原料制备 ,
,
写出合成路线:____________________________。(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
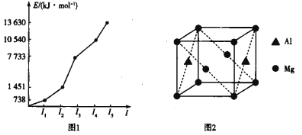
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:

①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
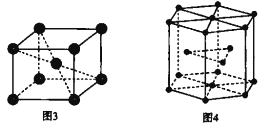
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com