
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中阴极产物为:_____________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为:_________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。


图2电池负极区的电极反应为:_______________;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为____________________,若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是___________(填A或B)电极。
【答案】②③ NaOH和H2 CnH2nOn-4ne-+nH2O=nCO2+4nH+ BH4--8e-+8OH-=BO2-+6H2O 红 O2+2H2O+4e-=4OH- B
【解析】
(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌作负极被腐蚀,铁作正极被保护;③装置为电解池,铁作阴极被保护;
(2)CnH2nOn的电极为负极,电极反应为:CnH2nOn-4ne-+nH2O=nCO2+4nH+;
(3)图2负极是BH4-发生氧化反应;原电池发生吸氧腐蚀,正极是氧气得电子生成大量的氢氧化钠,能使酚酞变红色;若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则阳极放电的是I-离子,反应产生I2,b为阳极,与正极B相连。
(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌为负极被腐蚀,,Fe作正极被保护;③装置为电解池,铁作阴极被保护;②③装置中铁被保护;装置③中发生的是电解饱和食盐水的反应,阳极是Cl-失电子生成Cl2,阴极是H+得到电子,反应产生H2,H+放电发生还原反应,破坏了附近的水的电离平衡,水进一步电离,最终附近溶液中c(OH-)>c(H+),所以阴极附近溶液中含有大量NaOH,故装置③中阴极产物为:H2、NaOH;
(2)通入CnH2nOn的电极为负极,电极反应为:CnH2nOn-4ne-+nH2O=nCO2+4nH+;
(3)图2燃料电池的负极是BH4-发生氧化反应,电极反应式为BH4--8e-+8OH-=BO2-+6H2O;正极上H2O2获得电子变为OH-,电极反应式为H2O2+2e-=2OH-;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,构成原电池,则a电极是锌板,锌电极为负极,锌失电子,铅笔芯为正极,O2得电子,在该极生成大量的氢氧化钠,使溶液显碱性,酚酞溶液变为红色;c位置的电极反应式为O2+2H2O+4e-=4OH-;若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则阳极放电的是I-,为阳极,b电极与电源的正极B相连。


科目:高中化学 来源: 题型:
【题目】某热再生电池工作原理如下图所示。通入![]() 时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:
时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。已知电池总反应:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
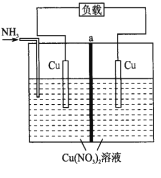
A. 此电池为二次电池
B. 放电时,左边电极发生氧化反应
C. a为阳离子交换膜
D. 放电时,转移![]() 电子,两电极质量变化的差值为
电子,两电极质量变化的差值为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是

A.该装置可以将光能转化为电能,同时也能转化为化学能
B.TiO2电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如下图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是

A. 乙装置中盛放的是饱和食盐水
B. 丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出
C. 丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气
D. 实验结束后,分离碳酸氢钠的操作是蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的A为直流电源,B为渗透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
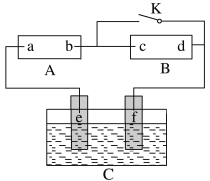
(1)电源A中a点为________极。
(2)滤纸B上发生氧化反应的电极反应方程式为:____________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路:
①电极e上发生的反应为:__________________;
②在此过程中电解液的浓度(填“始终不变”、“略微增大”、“略微减小”)___________;
③电镀槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉可以除去废液中的NaNO3,发生反应的化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为_____________________________。
(2)该反应的还原剂为___________(填化学式,下同),还原产物为_____________。
(3)2.7g铝粉参与反应,溶液的质量增加_________g。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
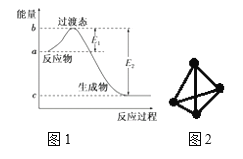
(1)图1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l)+ 1/2O2(g)═CO2(g)+2H2(g)△H= -a kJ·mol-1 ,则a________726.5(填“>”、“<”或“=”)。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2所示),与白磷分子相似。已知断裂1mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为2 mol N2时的△H= ________。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化如图:
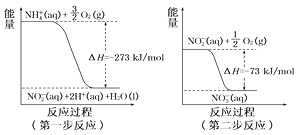
第二步反应是________反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳呼吸电池被誉为改变世界的创新技术,设想用碳呼吸电池为锂硫电池充电的装置如下图所示,下列说法不正确的是
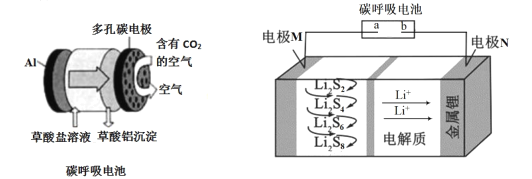
A.a极是多孔碳电极
B.充电时,外电路中流过0.02 mol电子,电极N质量增加0.14 g
C.随着反应的进行,碳呼吸电池中C2O42- 数目不断减小
D.充电时间越长,电池中的Li2S8量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com