
【题目】根据要求回答问题:
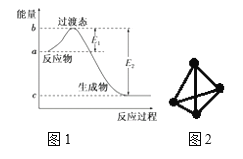
(1)图1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l)+ 1/2O2(g)═CO2(g)+2H2(g)△H= -a kJ·mol-1 ,则a________726.5(填“>”、“<”或“=”)。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2所示),与白磷分子相似。已知断裂1mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为2 mol N2时的△H= ________。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化如图:
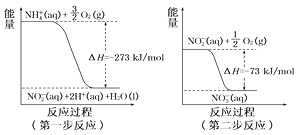
第二步反应是________反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是_____________。
【答案】减小 不变 < 724kJmol1 放热 ![]()
【解析】
(1)催化剂能降低反应所需的活化能,但催化剂不能改变反应物的总能量和生成物的总能量之差,据此分析;
(2)写出甲醇和氢气燃烧的热化学方程式,与题给的热化学方程式联立,然后根据盖斯定律,即可做出判断;
(3)本小题要注意一个N4分子中含有6个N-N键,要乘以6;
(4)根据盖斯定律和热化学方程式的书写要求作答;
(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响;
故答案为:减小;不变;
(2)①![]()
②![]()
③![]()
根据盖斯定律,①=②+③,即![]() =
=![]() +
+![]() ,因为
,因为![]() 、
、![]() 、
、![]() 均小于0,所以a<726.5
均小于0,所以a<726.5
故答案为:<;
(3) 从结构图中可看出,一个N4分子中含有6个N-N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)的△H=6×193kJmol-1-2×941kJmol-1=-724 kJmol-1,
故答案为:724kJmol1;
(4)由图可知,第二步反应的焓变小于0,所以第二步反应为放热反应;第一步的热化学方程式为![]() ,第二步的热化学方程式为:
,第二步的热化学方程式为:![]() ,根据盖斯定律则
,根据盖斯定律则![]() ,
,
故答案为:![]() ;
;


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中阴极产物为:_____________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为:_________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。


图2电池负极区的电极反应为:_______________;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为____________________,若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是___________(填A或B)电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18g碳单质与标准状况下22.4LO2反应放出热量是Q1kJ,已知由碳单质生成1molCO2气体放热Q2kJ。下列说法不正确的是( )
A. 由碳燃烧生成CO的热化学方程式是C(s)+1/2O2(g)=CO(g) △H=(Q1-0.5Q2)kJ/mol
B. 由碳燃烧生成1molCO放出的热量是(Q1-0.5Q2)kJ
C. 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)=2CO(g) △H=(Q2-2Q1)kJ/mol
D. 碳和CO2反应的热化学方程式是C(s)+CO2(g)=2CO(g) △H=(2Q2-2Q1)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+
已知该反应的速率随c(H+)的增大而加快。下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是
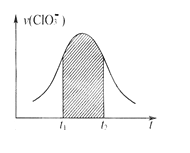
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 纵坐标为v(H+)的v-t曲线与图中曲线完全重合
D. 后期反应速率下降的主要原因是反应物浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出B、C、E元素的名称B___________、C__________、E_____________。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为____________。
(3)不能验证C和F两种元素非金属性强弱的结论是(填编号)________。
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为________、________,这两种酸式盐相互反应的离子方程式为_______。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________。
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a﹣b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】腈亚胺与邻酚羟基苄醇在碱的作用下可以发生偶联反应生成醚键,反应的条件温和,操作简单,目标产物收率高。下面是利用该方法合成化合物H的一种方法:
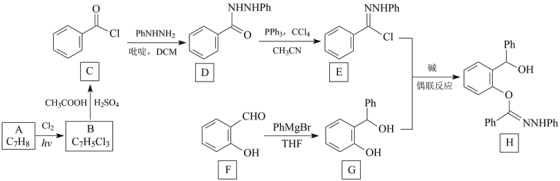
注:以上合成路线中,Ph代表苯基,如PhNHNH2表示![]() 。
。
实验 | 碱 | 温度/℃ | 溶剂 | 产率% |
1 | Et3N | 25 | DCM | <10 |
2 | 吡啶 | 25 | DCM | <5 |
3 | Cs2CO3 | 25 | DCM | 70 |
4 | LiOtBu | 25 | DCM | 43 |
5 | Cs2CO3 | 25 | DMF | 79 |
6 | Cs2CO3 | 25 | CH3CN | 83 |
回答下列问题:
(1)A的化学名称为_________,B的结构简式为___________。
(2)由C生成D的反应类型是________,F中的官能团名称是___________。
(3)H的分子式为_______________。
(4)不同条件对偶联反应生成H产率的影响如上表:
观察上表可知,当选用DCM作溶剂时,最适宜的碱是____________,由实验3、实验4和实验5可得出的结论是:25℃时,____________________,H产率最高。
(5)X为G的同分异构体,写出满足下列条件的X的结构简式:____________。
①所含苯环个数与G相同;②有四种不同化学环境的氢,其个数比为1:1:2:2
(6)利用偶联反应,以![]() 和化合物D为原料制备
和化合物D为原料制备 ,
,
写出合成路线:____________________________。(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=12的X、Y两种碱溶液各10mL,分别稀释至1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
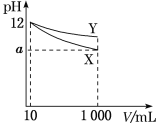
A. 若10<a<12,则X、Y都是弱碱
B. X、Y两种碱的物质的量浓度一定相等
C. 完全中和pH相同的X、Y两溶液时,消耗同浓度盐酸的体积:V(X)>V(Y)
D. 稀释后,X溶液的碱性比Y溶液的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质 B2、C2、D2、E2 在常温常压下都是气体,化合物 G 在焰色反应中显黄色;化合物I、J、K 通常状况下呈气态。下列说法正确的是
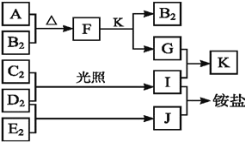
A.E 的氢化物沸点高于B 的氢化物沸点
B.G 为强碱弱酸盐,可用于厨房去油污
C.F 中既含有离子键又含有极性共价键
D.原子半径:A>C>B>E>D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com