
【题目】用18g碳单质与标准状况下22.4LO2反应放出热量是Q1kJ,已知由碳单质生成1molCO2气体放热Q2kJ。下列说法不正确的是( )
A. 由碳燃烧生成CO的热化学方程式是C(s)+1/2O2(g)=CO(g) △H=(Q1-0.5Q2)kJ/mol
B. 由碳燃烧生成1molCO放出的热量是(Q1-0.5Q2)kJ
C. 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)=2CO(g) △H=(Q2-2Q1)kJ/mol
D. 碳和CO2反应的热化学方程式是C(s)+CO2(g)=2CO(g) △H=(2Q2-2Q1)kJ/mol
【答案】A
【解析】
A.因为碳单质生成1molCO2气体放热Q2kJ,则C(s)+O2(g) = CO2(g) △H2=-Q2kJ/mol,18g碳的物质的量为18g÷12g/mol=1.5mol,标准状况下,22.4LO2的物质的量为1mol,根据2C+O2![]() 2CO、C+O2
2CO、C+O2![]() CO2,所以生成CO 1mol,生成CO20.5mol,放热为Q1kJ热量,所以由碳燃烧生成CO的热化学方程式是C(s)+1/2O2(g)=CO(g) △H=-(Q1-0.5Q2)kJ/mol,A项错误;
CO2,所以生成CO 1mol,生成CO20.5mol,放热为Q1kJ热量,所以由碳燃烧生成CO的热化学方程式是C(s)+1/2O2(g)=CO(g) △H=-(Q1-0.5Q2)kJ/mol,A项错误;
B.根据A选项分析可知,由碳燃烧生成1molCO放出的热量是(Q1-0.5Q2)kJ,B项正确;
C.根据A选项分析可知,由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)=2CO(g) △H=(Q2-2Q1)kJ/mol,C项正确;
D.①C(s)+O2(g) = CO2(g) △H2=-Q2kJ/mol,②2C(s)+O2(g)=2CO(g) △H=(Q2-2Q1)kJ/mol,②-①得碳和CO2反应的热化学方程式是C(s)+CO2(g)=2CO(g) △H=(2Q2-2Q1)kJ/mol,D项正确;
答案选A。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】元素A、B、D、E、F、G均为短周期主族元素,且原子序数依次增大,只有E为金属元素。已知A原子只有一个电子层;E、F的原子序数分别是B、D的2倍,其中D、F同主族,B、E不同主族。回答下列问题:
(1)元素D在周期表中的位置____。
(2)F和G形成的化合物,分子中所有原子均为8电子稳定结构,该化合物的电子式为____。
(3)由上述元素组成的物质中,按下列要求写出化学方程式
①两种弱酸反应生成两种强酸______;
②置换反应,且生成物在常温均为固态____。
(4)在D、F、G中选取2种元素组成具有漂白、杀菌作用的化合物___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如下图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是

A. 乙装置中盛放的是饱和食盐水
B. 丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出
C. 丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气
D. 实验结束后,分离碳酸氢钠的操作是蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉可以除去废液中的NaNO3,发生反应的化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为_____________________________。
(2)该反应的还原剂为___________(填化学式,下同),还原产物为_____________。
(3)2.7g铝粉参与反应,溶液的质量增加_________g。
(4)铝箔表面易形成致密的氧化膜,加热铝箔,铝箔熔化但不滴落,说明____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
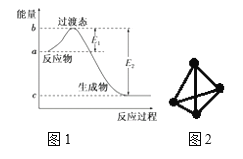
(1)图1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l)+ 1/2O2(g)═CO2(g)+2H2(g)△H= -a kJ·mol-1 ,则a________726.5(填“>”、“<”或“=”)。
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图2所示),与白磷分子相似。已知断裂1mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则1 mol N4气体转化为2 mol N2时的△H= ________。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。这两步的能量变化如图:
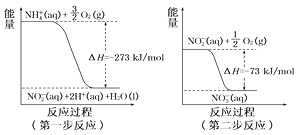
第二步反应是________反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取
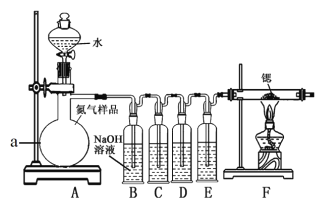
(1)仪器a的名称是__________________。
(2)装置C、D、E盛装的试剂分别是_______________(填代号)。
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案 ____。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)
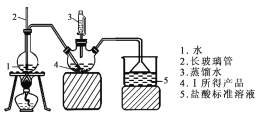
(4)三颈烧瓶中发生反应的化学方程式为 _________________________________。
(5)装置中长玻璃管的作用原理是_________。
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为__________________。
(7)产品纯度为_____________。(保留三位有效数字)
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是____________(填字母)。
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com