
| A.测Zn的相对原子质量可以通过测Zn的质量以及这些Zn和过量的稀硫酸反应时放出H2的体积 |
| B.测Na2CO3、NaHCO3混合物中Na2CO3的质量分数可以通过测样品的质量及样品和过量Ba(OH)2溶液反应的沉淀的质量 |
| C.测中和热时,可以用稀氨水代替NaOH溶液 |
| D.将淀粉溶液滴入某混合液中,检验是否含有碘化钾 |
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源:不详 题型:实验题

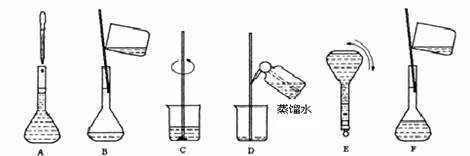
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 浓氨水 | 生石灰 | AgNO3溶液 | 无明显现象 | NH3与AgNO3溶液不反应 |
| B | 盐酸 | 碳酸钠 | BaCl2溶液 | 变浑浊 | 盐酸酸性强于碳酸 |
| C | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 紫色褪去 | 乙炔可被KMnO4氧化 |
| D | 浓硫酸 | 亚硫酸钠 | 溴水 | 橙色褪去 | SO2具有漂白性 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
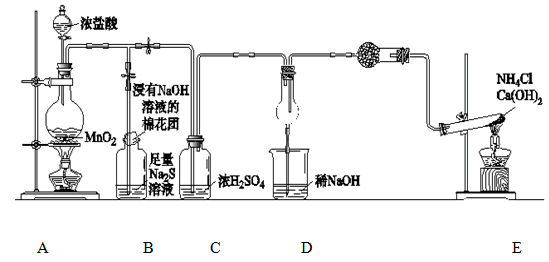
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液 |
| C | 比较盐酸与醋酸的酸性强弱 | 分别测定同温同浓度NaCl与CH3COONa溶液的pH |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
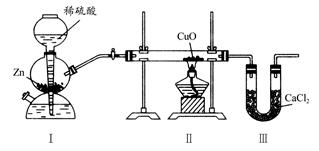
| A.Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B.Ⅲ装置后缺少干燥装置 |
| C.Ⅱ装置中玻璃管内有水冷凝 |
| D.CuO没有全部被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积的盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
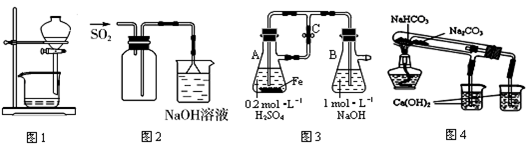
| A.图1用于放出碘的四氯化碳溶液 |
| B.图2用于实验室收集SO2 |
| C.图3用于实验室制备Fe(OH)2 |
| D.图4用于比较NaHCO3和Na2CO3热稳定性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 (填序号); 试管B中加1%品红溶液; 试管C中加 (填序号)。 | 若___ ___, 则甲成立。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com