
【题目】根据已学知识,请你回答下列问题:
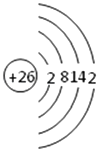
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图 .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4 , 该元素的名称是 .
(4)已知下列化学键的键能:Si﹣O:460kJ/mol,Si﹣Si:175kJ/mol,O=O:498kJ/mol,则反应:Si+O2=SiO2的反应热△H= .
(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用和杂化形式,其空间构型分别为和 .
(6)用氢键表示法表示HF水溶液中的所有氢键、、、 .
【答案】
(1)
(2)Si或S
(3)硒
(4)﹣892KJ/mol
(5)sp2;sp3;V形;三角锥型
(6)F﹣H…F;F﹣H…O;O﹣F…F;O﹣H…O
【解析】解:(1.)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,其原子结构示意图为:  ,所以答案是:
,所以答案是: 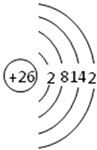 ;
;
(2.)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,所以当另一个3p轨道上没有电子,该原子是Si;一种是另一个3p轨道上充满电子,该原子是S,所以答案是:Si或S;
(3.)原子的外围电子排布是4s24p4 , 说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,所以答案是:硒;
(4.)△H=反应物的键能和﹣生成物的键能和=2×175KJ/mol+498KJ/mol﹣4×460KJ/mol=﹣892KJ/mol,所以答案是:﹣892KJ/mol;
(5.)二氧化硫分子是O原子价层电子对2+ ![]() (6﹣2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+
(6﹣2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+ ![]() (6﹣2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
(6﹣2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
水合氢离子中氧原子的价层电子对3+ ![]() (6﹣1﹣3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,所以答案是:sp2;sp3;V形;三角锥型;
(6﹣1﹣3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,所以答案是:sp2;sp3;V形;三角锥型;
(6.)N、O、F和氢原子之间能形成氢键,F的氢化物溶液剂为氢氟酸的水溶液,含有HF分子以及H2O分子,存在的所有氢键为F﹣H…F、F﹣H…O、O﹣F…F、O﹣H…O,所以答案是:F﹣H…F、F﹣H…O、O﹣F…F、O﹣H…O.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6 , 若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )
A.(3a+0.5b)mol
B.(3a+0.5b)mol
C.(3a+0.5b+3p)mol
D.(3a+0.5b﹣3p)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,元素的金属性和非金属性及其强弱比较与周期序数(n)和主族序数(A)有如下经验公式:K= ![]() (K为A与n的比值).下列推理正确的是( )
(K为A与n的比值).下列推理正确的是( )
A.当A一定时,K值越小,则元素的非金属性越强
B.当K=0,则该元素系同一周期中最活泼的金属元素
C.当n一定时,随着K值增大,则元素的非金属性逐渐增强
D.当K=l时,则该元素系过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为长式周期表的一部分,其中的编号代表对应的元素. 
请回答下列问题:
(1)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示).
(2)某元素的价电子排布式为nsnnpn+1 , 该元素与元素①形成的18电子的X分子的结构式为;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为 .
(3)比较③,⑤,⑥,⑦,⑧五种元素的电负性大小,由大到小排列的顺序为(用 元素符号表示).
(4)⑩元素单质晶体采取堆积方式 , 空间利用率为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红素中含有C、O、N、Fe五种元素.回答下列问题:
(1)C、N、O三种元素中电负性最小的是 . (填元素符号),写出基态Fe原子的核外电子排布式(简写) .
(2)如图1所示为血红蛋白和肌红蛋白的活性部分﹣﹣血红素的结构式.血红素中N原子的杂化方式有 , 在如图2的方框内用“→”标出Fe2+的配位键. 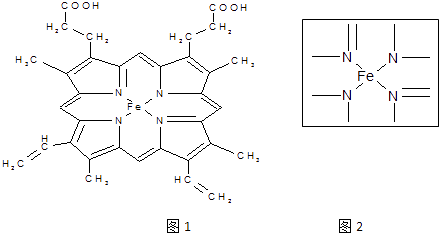
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiOFeO (填“<”或“>”).
(4)根据等电子原理,写出CN﹣的电子式 , 1mol O22+中含有的π键数目为 .
(5)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 , δ、α两种晶胞中铁原子的配位数之比为 . 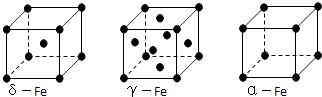
(6)现有两种组成皆为TiCl3.6H2O的晶体,其中 Ti3+的配位数均为6,但一种为紫色,
另一种为绿色.为测定这两种晶体的化学式,进行实验:
①两种配合物晶体各取1mol配成待测溶液;
②分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
③沉淀完全后分别过滤、洗涤、干燥后称量,发现原紫色晶体的水溶液与AgNO3溶液反应得到的白色沉淀为3mol,绿色晶体的水溶液反应得到的白色沉淀为2mol.则绿色晶体的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的结构简式如图,关于它的性质不正确的说法是( ) 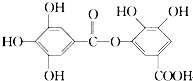
A.它有酸性,1 mol该物质最多能与6 mol H2发生加成反应
B.在一定条件下,1 mol该物质最多能和4 mol Br2反应
C.它可以水解,水解产物为两种有机物
D.该有机物能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 等物质的量的NO和NO2同时被NaOH溶液吸收:NO + NO2 +2OH-= 2NO2-+H2O
B. 等物质的量的MgCl2、Ba(OH)2和 HCl 溶液混合:Mg2++3OH﹣+H+=Mg(OH)2↓+H2O
C. 铅蓄电池充电时的阴极反应:PbSO4+2H2O﹣2e﹣=PbO2+4H++SO42﹣
D. 以金属银为阳极电解饱和NaCl溶液:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com