
【题目】在一定条件下,在体积为VL的密闭容器中发生反应:mA+nBpC.t秒末,A减少了1mol,B减少了1.25mol,C增加了0.5mol.则m:n:p应为( )
A.4:5:2
B.2:5:4
C.1:3:2
D.3:2:1
科目:高中化学 来源: 题型:
【题目】在2A+B3C+5D反应中,表示该反应速率最快的是( )
A.v(A)═0.5 mol/(Ls)
B.v(B)═0.3mol/(Ls)
C.v(C)═0.8 mol/(Ls)
D.v(D)═1mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:(写一点即可).
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 .
②A口排出的是(填“淡水”或“浓水”)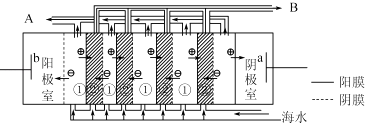
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下 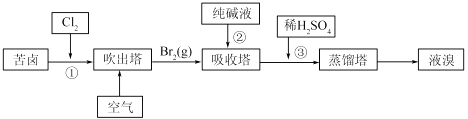
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为:
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? .
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 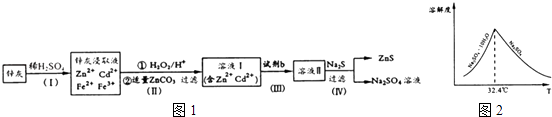
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000molL﹣1的NaOH溶液分别滴定20.00mL浓度均为0.1000molL﹣1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( ) 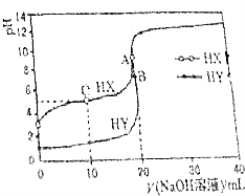
A.根据滴定曲线,可得Ka(CH3COOH)≈10﹣5
B.pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL
C.C点溶液:c(HX)>c(X﹣)>c(Na+)>c(H+)>c(OH﹣)
D.当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式或化学方程式.
(1)用稀硫酸清除铁锈(Fe2O3)(写出离子方程式):
(2)FeCl3溶液中加入NaOH溶液(写出离子方程式):
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式):
(4)少量CO2通入澄清石灰水中(写出离子方程式): .
(5)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳和硫的化合物的性质,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下: 6FeO(s)+CO2(g)═2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1
①上述反应的还原产物为 , 每生成1mol Fe3O4 , 转移电子的物质的量为mol;
②已知:C(s)+2H2O(g)═CO2(g)+2H2(g)△H=+113.4kJmol﹣1 , 则反应:
3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)的△H= .
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)CH4(g)+2H2O(g).向一容积为2L的恒容密闭容器中充入一定量的CO2和H2 , 在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL﹣1 , H2 0.8molL﹣1 , CH4 0.8molL﹣1 , H2O 1.6molL﹣1 . 则300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的△H(填“>”或“<”)0.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用含硫酸铜的工业废液制备硫酸铵,流程如下: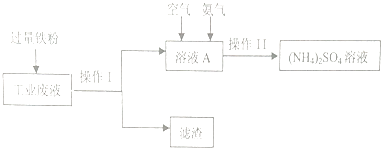
(1)操作Ⅰ的名称为 , 滤渣的成分为 .
(2)工业废液中加入过量铁粉所发生反应的离子方程式为 .
(3)操作Ⅱ得到的(NH4)2SO4溶液进行蒸发浓缩,需要的仪器除了酒精灯、铁架台、蒸发皿外,还需要 .
(4)如图溶液A中发生反应的离子方程式为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓该反应是否为氧化还原反应(填“是”或“否”).
(5)检验(NH4)2SO4溶液中含有SO ![]() 的方法为 .
的方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 常温常压下,18gH2O中含氢原子数为NA
B. 标准状况下,5.6L四氯化碳中含有的氯原子数为NA
C. 常温下,1mol·L-1NaClO溶液中含有的钠离子数为NA
D. 标准状况下,14gCO和N2的混和气体中含有的原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com