
【题目】写出下列反应的离子方程式或化学方程式.
(1)用稀硫酸清除铁锈(Fe2O3)(写出离子方程式):
(2)FeCl3溶液中加入NaOH溶液(写出离子方程式):
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式):
(4)少量CO2通入澄清石灰水中(写出离子方程式): .
(5)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式) .
【答案】
(1)Fe2O3+6H+=2Fe3++3H2O
(2)Fe3++3OH﹣═Fe(OH)3↓
(3)H++HCO ![]() =CO2↑+H2O
=CO2↑+H2O
(4)CO2+Ca2++2OH﹣═CaCO3↓+H2O
(5)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
【解析】解:(1)用稀硫酸清除铁锈(Fe2O3),离子方程式:Fe2O3+6H+=2Fe3++3H2O;所以答案是:Fe2O3+6H+=2Fe3++3H2O;(2)FeCl3溶液中加入NaOH溶液,反应的离子方程式:Fe3++3OH﹣═Fe(OH)3↓;所以答案是:Fe3++3OH﹣═Fe(OH)3↓;(3)盐酸与碳酸氢钠反应生成氯化钠、水和二氧化碳,离子方程式:H++HCO ![]() =CO2↑+H2O;所以答案是:H++HCO3﹣=CO2↑+H2O;(4)少量CO2通入澄清石灰水中,反应生成碳酸钙和水,离子方程式:CO2+Ca2++2OH﹣═CaCO3↓+H2O;所以答案是:CO2+Ca2++2OH﹣═CaCO3↓+H2O;(5)Cu2++2OH﹣=Cu(OH)2↓表示可溶性铜盐与强碱反应生成氢氧化铜沉淀和可溶性盐,可以表示硫酸铜与氢氧化钠反应的离子方程式,该反应化学方程式为:Cu SO4+2NaOH=Cu(OH)2↓+Na2SO4;所以答案是:Cu SO4+2NaOH=Cu(OH)2↓+Na2SO4 .
=CO2↑+H2O;所以答案是:H++HCO3﹣=CO2↑+H2O;(4)少量CO2通入澄清石灰水中,反应生成碳酸钙和水,离子方程式:CO2+Ca2++2OH﹣═CaCO3↓+H2O;所以答案是:CO2+Ca2++2OH﹣═CaCO3↓+H2O;(5)Cu2++2OH﹣=Cu(OH)2↓表示可溶性铜盐与强碱反应生成氢氧化铜沉淀和可溶性盐,可以表示硫酸铜与氢氧化钠反应的离子方程式,该反应化学方程式为:Cu SO4+2NaOH=Cu(OH)2↓+Na2SO4;所以答案是:Cu SO4+2NaOH=Cu(OH)2↓+Na2SO4 .


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.2 mol·L-1与0.1 mol·L-1 HClO溶液中c(H+)之比为2:1
B. pH=2和pH=1的硝酸中c(H+)之比为1:2
C. 25 ℃时,0.1 mol·L-1CH3COOH的电离平衡常数K=2×10-5,则0.1 mol·L-1CH3COONa的水解平衡常数为5×10-10
D. 0.1 mol·L-1NaHCO3溶液中:c (Na+)+ c (H+)+ c (H2CO3)<c (HCO3-) +3 c (CO32-) + c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)pH=2的HCl溶液稀释1000倍,所得溶液的PH
(2)pH=2的CH3COOH溶液稀释1000倍,所得溶液的PH范围
(3)pH=11的NaOH溶液稀释100倍,所得溶液的PH
(4)pH=11的NH3H2O溶液稀释100倍,所得溶液的PH范围
(5)pH=3和pH=5的两种盐酸溶液等体积混合,所得溶液PH
(6)pH=8和pH=13的两种氢氧化钠溶液等体积混合,所得溶液PH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________;所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式表示其原因:__________;所得溶液中各离子物质的量浓度由大到小的顺序是____________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH![]() )=a moL.L-1,则c(SO42-)为________。
)=a moL.L-1,则c(SO42-)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在体积为VL的密闭容器中发生反应:mA+nBpC.t秒末,A减少了1mol,B减少了1.25mol,C增加了0.5mol.则m:n:p应为( )
A.4:5:2
B.2:5:4
C.1:3:2
D.3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示. 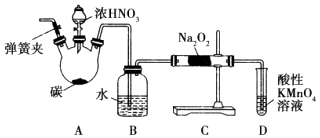
已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2﹣都能与MnO4﹣反应生成NO3﹣和Mn2+ .
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体X,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡.则X为 , 上述操作的作用是 .
(2)B中观察到的主要现象是 .
(3)A中盛装浓HNO3的仪器名称为 , A装置中反应的化学方程式为 .
(4)D装置中反应的离子方程式为 .
(5)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3和 . 为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为 .
(6)利用改进后的装置,将3.12g Na2O2完全转化成为NaNO2 , 理论上至少需要木炭g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: 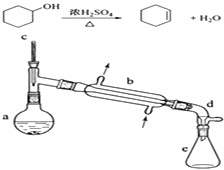
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是 .
(2)加入碎瓷片的作用是;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并;在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是 .
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 ABE (填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是 . (保留两位有效数字)
(注:产率= ![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A. 肯定有SO2和NO B. 肯定没有Cl2和NO2 ,可能有O2
C. 可能有Cl2和O2 D. 肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然酿酒酵母菌通常缺乏分解淀粉的酶类,用作发酵原料的淀粉需经一系列复杂的转化过程才能被利用.研究者从某丝状真菌中获取淀粉酶基因并转入酿酒酵母菌,获得的酿酒酵母工程菌可直接利用淀粉产生酒精.请回答下列问题:
(1)将淀粉酶基因切割下来所用的工具是 ,用 将淀粉酶基因与载体拼接成新的DNA分子,此表达载体除目的基因外,必须含有 、 和标记基因.
(2)若要鉴定淀粉酶基因是否插入酿酒酵母菌,可采用的检测方法 ,该项方法要用 作探针进行检测;若要鉴定淀粉酶基因是否翻译成淀粉酶,可采用 方法检测.
(3)采用PCR技术可对目的基因进行体外扩增.该反应体系的主要成分应包含:扩增缓冲液(含Mg2+)、水、4种dNTP、模板DNA、引物和 .其中引物有 种,实质是 ,假如引物都用3H标记,从理论上计算循环4次,所得DNA分子中含有3H标记的占 .
(4)已知BarnHⅠ与BglⅡ的识别序列及切割位点如图所示,用这两种酶和DNA连接酶对一段含有数个BarnHⅠ和BglⅡ识别序列的DNA分子进行反复的切割、连接操作,若干循环后 序列明显增多.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com