
【题目】根据所学知识填空
(1)pH=2的HCl溶液稀释1000倍,所得溶液的PH
(2)pH=2的CH3COOH溶液稀释1000倍,所得溶液的PH范围
(3)pH=11的NaOH溶液稀释100倍,所得溶液的PH
(4)pH=11的NH3H2O溶液稀释100倍,所得溶液的PH范围
(5)pH=3和pH=5的两种盐酸溶液等体积混合,所得溶液PH
(6)pH=8和pH=13的两种氢氧化钠溶液等体积混合,所得溶液PH .
【答案】
(1)5
(2)2-5
(3)9
(4)9-11
(5)3.3
(6)12.7
【解析】解:(1)pH=a的强酸加水稀释至原来体积的10b倍,则pH=a+b,故将pH=2的HCl溶液稀释103倍,所得溶液的pH=5,所以答案是:5;
(2.)pH=a的弱酸加水稀释至原来体积的10b倍,则a<pH<a+b,故将pH=2的醋酸溶液稀释103倍,所得溶液pH介于2到5之间,所以答案是:2﹣5;
(3.)pH=c的强碱加水稀释至原来体积的10d倍,则pH=c﹣d,故pH=11的NaOH溶液稀释102倍,所得溶液的pH=9,所以答案是:9;
(4.)pH=c的弱碱加水稀释至原来体积的10d倍,则c<pH<c﹣d,故pH=11的氨水溶液稀释102倍,所得溶液的pH介于9到11之间,所以答案是:9﹣11;
(5.)pH=3和pH=5的两种盐酸溶液等体积混合,溶液仍然显酸性,混合溶液中c(H+)= ![]() ≈5×10﹣4mol/L,故pH=﹣lgc(H+)=4﹣lg5=3.3,所以答案是:3.3;
≈5×10﹣4mol/L,故pH=﹣lgc(H+)=4﹣lg5=3.3,所以答案是:3.3;
(6.)pH=8和pH=13的两种氢氧化钠溶液等体积混合,溶液显碱性,混合溶液中c(OH﹣)= ![]() =
= ![]() ≈5×10﹣2mol/L,故c(H+)=2×10﹣13mol/L,pH=﹣lgc(H+)=12.7,所以答案是:12.7.
≈5×10﹣2mol/L,故c(H+)=2×10﹣13mol/L,pH=﹣lgc(H+)=12.7,所以答案是:12.7.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酸性氧化物都不能与酸发生反应
B.氯水中的次氯酸具有杀菌消毒的作用
C.铵盐受热分解都能放出氨气
D.生物固氮是指植物通过叶面直接吸收空气中的氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A处通入Cl2 , 关闭B阀时,C处的红布看不到明显现象;当打开B阀后,C处红布条逐渐褪色.则D瓶中装的是( ) 
A.浓盐酸
B.NaOH溶液
C.H2O
D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料.为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中A1N的含量,某实验小组设计了如下两种实验方案.
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).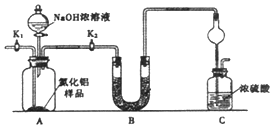
(1)如图C装置中球形干燥管的作用是 .
(2)完成以下实验步骤:组装好实验装置后,首先 ,
再加入实验药品.接下来关闭K1 , 打开K2 , 打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1 , 通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是 .
(3)装置B中试剂可以为(选正确序号填空).
①浓硫酸 ②碱石灰 ③P2O5④还原铁粉
若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”).由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 .
(4)【方案2】按以下步骤测定样品中A1N的纯度: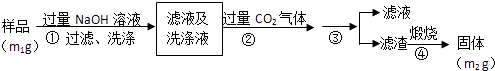
步骤②生成沉淀的离子方程式为 .
步骤③的操作是 . A1N的纯度是 (用m1、m2表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:(写一点即可).
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 .
②A口排出的是(填“淡水”或“浓水”)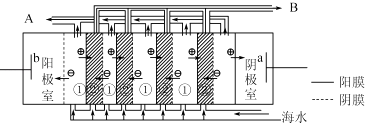
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下 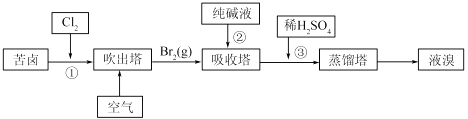
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为:
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? .
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应
B.1mol葡萄糖能水解生成2mol乙醇和2mol二氧化碳
C.戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同
D.异丙醇能发生取代反应、氧化反应、消去反应等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如图1所示. 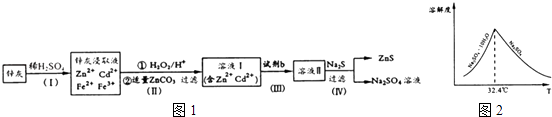
(1)为提高锌灰的浸取率,可采用的方法是(填序号).
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是(写化学式).
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S.
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取.化学反应方程式为
③已知Na2SO4 . 10H2O及Na2SO4的溶解度随温度变化曲线如图2.从滤液中得到Na2SO4.10H2O的操作方法是
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL,物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式或化学方程式.
(1)用稀硫酸清除铁锈(Fe2O3)(写出离子方程式):
(2)FeCl3溶液中加入NaOH溶液(写出离子方程式):
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式):
(4)少量CO2通入澄清石灰水中(写出离子方程式): .
(5)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向方向) 
已知以下信息:
i.A属于芳香烃,H属于酯类化合物.
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1.
回答下列问题:
(1)D的含氧官能团名称 , B的结构简式 .
(2)B→C和G→J两步的反应类型 , .
(3)①E+F→H的化学方程式 .
②I→G 的化学方程式 .
(4)H的同系物K比H相对分子质量小28,K有多种同分异构体.
①K的一种同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式 .
②若K的同分异构体既属于芳香族化合物,又能和饱和NaHCO3溶液反应放出CO2 . 则满足该条件的同分异构体共有种(不考虑立体异构).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com