
【题目】下列关于有机物的说法正确的是( )
A.苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应
B.1mol葡萄糖能水解生成2mol乙醇和2mol二氧化碳
C.戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同
D.异丙醇能发生取代反应、氧化反应、消去反应等
【答案】D
【解析】解:A.苯性质稳定,与高锰酸钾不反应,但苯的燃烧属于氧化还原反应,故A错误;B.葡萄糖不能发生水解反应,故B错误;
C.戊烷的三种同分异构体CH3CH2CH2CH2CH3、![]() 、
、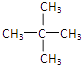 分别有3种、4种、1种氢原子,所以戊烷共能形成8种戊烷基,所以戊烷的一氯代物的同分异构体有8种,丙烷中含有两种类型的氢原子,取代同个碳原子上的氢原子和不同碳上的氢原子结构不一样,其二氯代物的同分异构体数目是4,故C错误;
分别有3种、4种、1种氢原子,所以戊烷共能形成8种戊烷基,所以戊烷的一氯代物的同分异构体有8种,丙烷中含有两种类型的氢原子,取代同个碳原子上的氢原子和不同碳上的氢原子结构不一样,其二氯代物的同分异构体数目是4,故C错误;
D.异丙醇含有羟基,可发生取代、氧化反应可生成丙酮,消去反应反应可生成丙烯,故D正确.
故选D.
【考点精析】解答此题的关键在于理解有机物的结构和性质的相关知识,掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加罗常数,下列叙述正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为NA
B.2.3gNa与足量的氧气发生反应,转移的电子数为0.2NA
C.通常情况下,32gO2与32gO3所含有的氧原子数均为2NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( ) 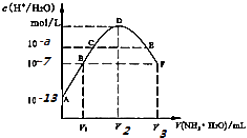
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14﹣a
C.E溶液中存在:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.B到D,D到F所加氨水体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)pH=2的HCl溶液稀释1000倍,所得溶液的PH
(2)pH=2的CH3COOH溶液稀释1000倍,所得溶液的PH范围
(3)pH=11的NaOH溶液稀释100倍,所得溶液的PH
(4)pH=11的NH3H2O溶液稀释100倍,所得溶液的PH范围
(5)pH=3和pH=5的两种盐酸溶液等体积混合,所得溶液PH
(6)pH=8和pH=13的两种氢氧化钠溶液等体积混合,所得溶液PH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:(写一点即可).
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 .
②A口排出的是(填“淡水”或“浓水”)
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下 
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为:
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? .
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________;所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式表示其原因:__________;所得溶液中各离子物质的量浓度由大到小的顺序是____________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH![]() )=a moL.L-1,则c(SO42-)为________。
)=a moL.L-1,则c(SO42-)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示. 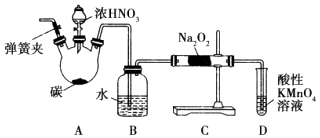
已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2﹣都能与MnO4﹣反应生成NO3﹣和Mn2+ .
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体X,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡.则X为 , 上述操作的作用是 .
(2)B中观察到的主要现象是 .
(3)A中盛装浓HNO3的仪器名称为 , A装置中反应的化学方程式为 .
(4)D装置中反应的离子方程式为 .
(5)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3和 . 为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为 .
(6)利用改进后的装置,将3.12g Na2O2完全转化成为NaNO2 , 理论上至少需要木炭g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示,下列说法正确的是( ) 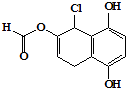
A.不能发生银镜发应
B.1mol 该物质最多可与2molBr2反应
C.1mol 该物质最多可与4mol NaOH反应
D.与NaHCO3、Na2CO3均能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com