
����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣�ش��������⣺
I.CO�����ڸ�¯��������֪
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) ��H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) ��H2=bkJ/mol
��ӦFe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)����H3=_________kJ/mol(�ú�a��b�Ĵ���ʽ��ʾ)
��.һ�������£�CO2��CO���Ի���ת����
��1��ij�¶��£����ݻ�Ϊ2L���ܱ��������ס������ַ�ʽͶ�뷴Ӧ�����Ӧ��CO2(g)+H2(g) ![]() CO(g)+H2O(g)��
CO(g)+H2O(g)��
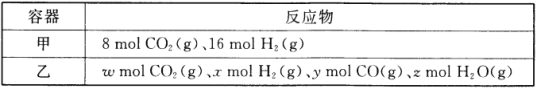
������15min��ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����0~15min��ƽ����Ӧ����v(H2)= _________���������¸÷�Ӧ��ƽ�ⳣ��K=_________��
��ʹƽ������������ͬ�����������������ȣ����ء�x��y��z������Ĺ�ϵ��_________����_________ (�ú�y�ĵ�ʽ��ʾ)��
��2���о��������¶ȡ�ѹǿ�Է�Ӧ��C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ��H�����ұ���ƽ��ת����Ӱ������ͼ��ʾ��
C6H5CH=CH2(g)+CO(g)+H2O(g) ��H�����ұ���ƽ��ת����Ӱ������ͼ��ʾ��
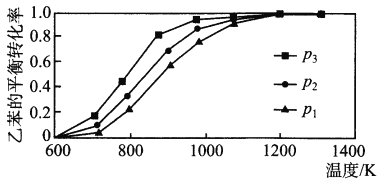
����H_________ 0(����>����<������=��)��ѹǿp1��p 2��p3�Ӵ�С��˳����_________��
��3��CO�ɱ�NO2������CO+NO2![]() CO2+NO�����¶ȸ���225��ʱ����Ӧ����v��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ_________��
CO2+NO�����¶ȸ���225��ʱ����Ӧ����v��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ_________��
���𰸡���b+2a��/3 0.2mol��L��1��min��1 1.8 x=2w+y z=y > p1>p2>p3 k=k��/k��
��������
��.���ݸ�˹���ɡ�H3=����H1+2��H2��/3��
��1��v(H2)=��c/��t����K=c(CO)��c(H2O)/c(CO2)��n(H2)����ƽ�ⳣ����
��ʹƽ������������ͬ�����������������ȣ���ء�x��y��z������Ĺ�ϵ(w-y):(x-y)=8:16��x=2w+y��z=y��
��2��ѹǿԽ��,�ұ���ƽ��ת����ԽС��
��3����ƽ��ʱv��=v������k����c(CO)��c(NO2)=k����c(CO2)��c(NO)���ɴ˼��㡣
��.���ݸ�˹���ɡ�H3=����H1+2��H2��/3=��b+2a��/3kJ/mol��
��1��v(H2)=8molx75%/(2L��15min)=0.2mol/(L��min)��
��Ӧ8mol��75%=6 mol CO2,��ƽ��ʱn(CO)=n(H2O)=6mol��n(CO2)=8 mol-6 mol=2 mol, n(H2)=16 mol-6 mol=10 mol��K=c(CO)��c(H2O)/c(CO2)��n(H2)=6molx6mol/(2mol��10mol)=l.8.
Ҫʹƽ������������ͬ������������������,������(w-y):(x-y)=8:16��x=2w+y��z=y��
��2���¶�Խ�ߡ��ұ���ƽ��ת����Խ��,������H>0���÷�Ӧ�ġ�n��>0����ѹǿԽ��,�ұ���ƽ��ת����ԽС,��p1>p2>p3��
��3����ƽ��ʱv��=v������k����c(CO)��c(NO2)=k����c(CO2)��c(NO)����k��/k��=c(CO2)��c(NO)/c(CO)��c(NO2)=k


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й������г������л����˵����ȷ����(����)
A.���͡������Ҵ���������������
B.��֬��������������ķ���ʹ��֬�����ƺ��ͷ���
C.�Ҵ��ܱ����������ᣬ���߶���������������Һ��Ӧ
D.ú�ĸ���ɵ�ú�ͣ����顢��ϩ�ͱ��ܴ�ʯ�ͷ���õ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����֪2A2��g����B2��g��![]() 2C3��g������H ����a kJ/mol��a��0������һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ��ƽ��ʱ�ų�����b kJ��
2C3��g������H ����a kJ/mol��a��0������һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ��ƽ��ʱ�ų�����b kJ��
��1���Ƚ�a___b��������������������
��2��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__________��
A����ʱ�����C3���� B���ʵ������¶�
C������B2��Ũ�� D��ѡ���Ч�Ĵ���
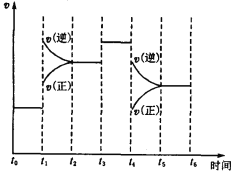
��3����ͼ��ʾ�˷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ��������ͼ�жϣ���t1��t4ʱ�̸ı����������ֱ���_______________�� _____________ ��
��������һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
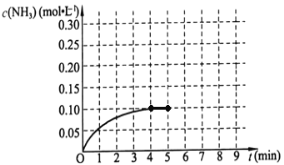
��1��������ͼ���÷�Ӧ�ﵽƽ��ʱH2��ת���ʵ���__________��
��2����5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ�����ƽ���NH3�����ʵ���Ũ�Ȳ�����Ϊ_________��������ţ���
a 0.20mol��L-1 b 0.12 mol��L-1 c 0.10 mol��L-1 d 0.08 mol��L-1
��3�����ڵ�5����ĩ�������������Сһ����ڵ�8���Ӵﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol��L-1 ����������ͼ�л�����5���ӵ�9����NH3Ũ�ȵı仯���ߡ�____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ�����Ƚ������о�Ժ�ɹ��з���һ�ָ�Ч�ͳɱ����ܵ����������һʯī��˫���ӵ�أ�����ܷ�ӦΪAl+xC+Li++PF6 ��![]() AlLi+Cx PF6�����йظõ�ص�˵����ȷ����
AlLi+Cx PF6�����йظõ�ص�˵����ȷ����
A. �ŵ�ʱ��PF6���������ƶ�
B. �ŵ�ʱ��������ӦΪA1��3e��====Al3+
C. ���ʱ�������缫���ӵ��������
D. ���ʱ��������ӦΪxC+PF6����e��==CxPF6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��������ʵ�������ȷ����
A. NaHSˮ�ⷴӦ��HS����H2O ![]() H3O����S2��
H3O����S2��
B. Fe(OH)2��ϡ���ᷴӦ��2H����Fe(OH)2=Fe2����2H2O
C. ������SO2ͨ�뵽Ư����Һ�У�ClO����SO2��H2O=HClO��HSO3-
D. Na2CO3ˮ��Һ�д���ƽ�⣺CO32��+H2O![]() HCO3��+OH��
HCO3��+OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״������ǿ��������õ�һ������Դ��
��֪��2H2(g)��O2(g)===2H2O(l)��H1����571.8 kJ/mol��
��CH3OH(g)��1/2O2(g)===CO2(g)��2H2(g)��H2����192.9 kJ/mol��
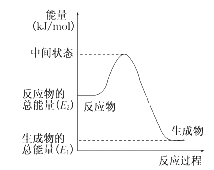
��1���״�������ȫȼ�յ��Ȼ�ѧ��Ӧ����ʽ_______��
��2����Ӧ���е������仯��ͼ��ʾ������H2��________ kJ/mol(��E1��E2��ʾ)��
��3��H2(g)��ȼ����Ϊ________������H2(g)��Ϊ��Դ�ȼ״�������Ϊ��Դ���ŵ㣺_____(д�����㼴��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������������ȷ����(����)
A. Ũ�Ⱦ�Ϊlmol/L�Ĵ���ʹ�������Һ�������ϣ���Һ��CH3COOH��CH3COO��������Ϊ2NA
B. 1molP4�������ۼ���ĿΪ4mol
C. 1 mol K2S��K2S2�Ļ�����к���������Ϊ3NA
D. 25 ��ʱ��1 L pH��12��Ba(OH)2��Һ�к��е�OH����ĿΪ0.02NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ں����ܱ������з������·�Ӧ��2A(g)+B(g)![]() 3C(g)������Ӧ��ʼʱ����2 mol A��2 mol B����ƽ���A���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���A�������������a%����
3C(g)������Ӧ��ʼʱ����2 mol A��2 mol B����ƽ���A���������Ϊa%��������������ʱ�������������������Ϊ��ʼ���ʣ�ƽ���A�������������a%����
A. 2.5mol C B. 2 mol A��2 mol B��10 mol He�����μӷ�Ӧ��
C. 1.5 mol B��1.5 mol C D. 2 mol A��3 mol B��3 mol C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯��������������;�㷺��
������������ɰ�ķ���һһȷþ��(��Ҫ�ɷ�ΪMgCO3.SiO2,����������Fe2O3��MnO��CaO��)Ϊ��Ҫԭ����ȡ����̼��þ[MgCO3:Mg(OH)2:2H2O]�Ĺ�ҵ��������:
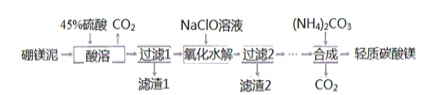
��1��д��������"һ���У�MgCO3�����ᷴӦ�����ӷ���ʽ________________________��
��2������2����Ҫ�ɷ���MnO2��____��д������MnO2�����ӷ���ʽ_____________��
��3�����ϳɡ�ʱ��ͨ������80�棬���ȱ߽��裬�¶Ȳ��ܳ�80���ԭ����________��
II.�Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��(CuFeS2)ұ��ͭ�Ĺ�����������:
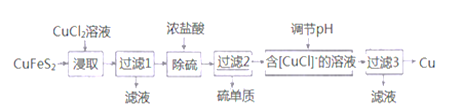
��֪:��CuFeS2+3CuCl2=4CuCl��+FeCl2+2S�� ��+1�۵�Cu���������������绯
��4����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ_______________��
��5��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ__________��
��6��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽���������______���������ӷ��ţ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com