
����Ŀ����һ����֪2A2��g����B2��g��![]() 2C3��g������H ����a kJ/mol��a��0������һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ��ƽ��ʱ�ų�����b kJ��
2C3��g������H ����a kJ/mol��a��0������һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ��ƽ��ʱ�ų�����b kJ��
��1���Ƚ�a___b��������������������
��2��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__________��
A����ʱ�����C3���� B���ʵ������¶�
C������B2��Ũ�� D��ѡ���Ч�Ĵ���
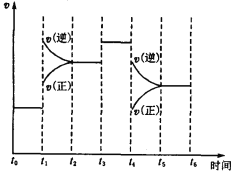
��3����ͼ��ʾ�˷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ��������ͼ�жϣ���t1��t4ʱ�̸ı����������ֱ���_______________�� _____________ ��
��������һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
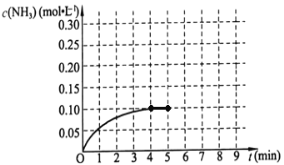
��1��������ͼ���÷�Ӧ�ﵽƽ��ʱH2��ת���ʵ���__________��
��2����5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ�����ƽ���NH3�����ʵ���Ũ�Ȳ�����Ϊ_________��������ţ���
a 0.20mol��L-1 b 0.12 mol��L-1 c 0.10 mol��L-1 d 0.08 mol��L-1
��3�����ڵ�5����ĩ�������������Сһ����ڵ�8���Ӵﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol��L-1 ����������ͼ�л�����5���ӵ�9����NH3Ũ�ȵı仯���ߡ�____________
���𰸡���C�����¶Ƚ���ѹǿ50%a��c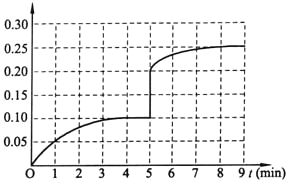
��������
(һ)(1)�Ȼ�ѧ����ʽ���������Ϊ����2mol A2��1mol B2��ȫ��Ӧʱ���ų�����ΪakJ��������2mol A2��1mol B2�ﵽƽ��ʱ��û����ȫ��Ӧ�����ͷŵ�����С����ȫ��Ӧ�ͷŵ���������a��b���ʴ�Ϊ������
(2)A����ʱ�����C3���壬ƽ�������ƶ�������Ӧ���ʼ�С���ʴ���B���ʵ������¶ȷ�Ӧ��������ƽ�������ƶ����ʴ���C������B2��Ũ�ȣ�ƽ�������ƶ��ҷ�Ӧ����������ȷ��D��ѡ���Ч�Ĵ�������Ӧ��������ƽ�ⲻ�ƶ����ʴ���ѡC��
(3)��2A2(g)��B2(g)![]() 2C3(g)����H ����a kJ/mol(a��0)����֪���÷�ӦΪ���ȷ�Ӧ����Ϊ���������С�ķ�Ӧ������ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ�����¶ȣ�t4ʱ���淴Ӧ���ʾ���С�����淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ����ѹǿ���ʴ�Ϊ�������¶ȣ�����ѹǿ��
2C3(g)����H ����a kJ/mol(a��0)����֪���÷�ӦΪ���ȷ�Ӧ����Ϊ���������С�ķ�Ӧ������ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ�����¶ȣ�t4ʱ���淴Ӧ���ʾ���С�����淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ����ѹǿ���ʴ�Ϊ�������¶ȣ�����ѹǿ��
(��)(1)��c(NH3)=0.1mol/L��Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ�������c(H2)=![]() ��c(NH3)=
��c(NH3)=![]() ��0.1mol/L=0.15mol/L���ʲμӷ�Ӧ�����������ʵ���Ϊ0.15mol/L��2L=0.3mol������������ת����Ϊ
��0.1mol/L=0.15mol/L���ʲμӷ�Ӧ�����������ʵ���Ϊ0.15mol/L��2L=0.3mol������������ת����Ϊ![]() ��100%=50%���ʴ�Ϊ��50%��
��100%=50%���ʴ�Ϊ��50%��
(2)�÷�ӦΪ���淴Ӧ����Ӧ�ﲻ������ȫת������NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L���¶ȸı�ƽ��һ�������ƶ�����NH3�����ʵ���Ũ�Ȳ�����Ϊ0.1mol/L���ʴ�Ϊ��a��c��
(3)��5����ĩ�������������Сһ���˲�䰱��Ũ��Ϊ0.20mol/L��ѹǿ����ƽ�������ƶ���������Ũ�������ڵ�8����ĩ�ﵽ�µ�ƽ��ʱNH3��Ũ��ԼΪ0.25molL-1����5����ĩ��ƽ��ʱNH3Ũ�ȵı仯����ͼ��Ϊ��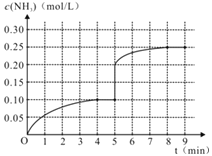 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽����������(����)
|
|
|
|
A.��ȡ����CO2,���濪����,�����ͣ | B.����һ�����ʵ���Ũ�ȵ�ϡ���� | C.���Ƶ�Fe(OH)2,���۲�����ɫ | D. ����ռ�NH3,�����ն����β�� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������FeCl3��Һ��Fe(OH)3��������ķ�����
A. ���� B. ���� C. ��ȡ D. �����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2-��ϩ��ʯ���ѽ�IJ���֮һ���ش��������⣺
��1���ڴ��������£�2-��ϩ��������Ӧ�Ļ�ѧ����ʽΪ_____________ ����Ӧ����Ϊ_______��
��2��ϩ��A��2-��ϩ��һ��ͬ���칹�壬���ڴ�����������������Ӧ�IJ��ﲻ�������飬��A�Ľṹ��ʽΪ__________ ��A�������ܹ���ƽ���̼ԭ�Ӹ���Ϊ_________ ����A��һ�������ºϳɸ߷��ӻ�����Ļ�ѧ����ʽΪ__________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A(g)��B(g)![]() 2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
��1����֪��A(g)��X(g)![]() 2B(g)����H����133.2 kJ��mol��1��
2B(g)����H����133.2 kJ��mol��1��
5A(g)��X(g)![]() 4C(g)����H����650.4 kJ��mol��1����a��________��
4C(g)����H����650.4 kJ��mol��1����a��________��
��2����ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ���ɴ˿���֪������T1________T2(����>������������<��)��
T/K | T1 | T2 | T3 |
K | 6.86 | 2.45 | 1.88 |
��3����������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2 mol A��1 mol B��500 ��ʱ��ַ�Ӧ��ƽ��ų�������Ϊd kJ����d________b(����>������������<��)��
��4����һ���¶��£���һ���ݻ��ɱ�ĺ�ѹ�����У�ͨ��3 mol A��2 mol B��������Ӧ2A(g)��B(g)![]() 2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��80%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼͶ������Ϊ6 mol A��4 mol B����ƽ��ʱA���������Ϊ________��
2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��80%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼͶ������Ϊ6 mol A��4 mol B����ƽ��ʱA���������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ѫ�쵰����Է�������ԼΪ68000����֪���к�������������Ϊ0.33%����ƽ��ÿ��Ѫ�쵰�ķ�������ԭ����ԼΪ �� ��
A.5B.4C.3D.2.408��1024
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��101 kPaʱ������������ȼ�������Ȼ�������������仯���������й�˵���в���ȷ����(����)
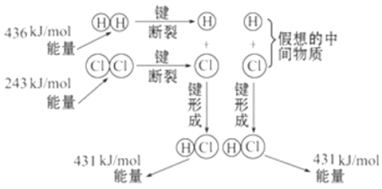
A. 1 mol H2�еĻ�ѧ������ʱ��Ҫ����436 kJ����
B. 2 mol HCl�����еĻ�ѧ���γ�ʱҪ�ͷ�862 kJ����
C. �˷�Ӧ���Ȼ�ѧ����ʽΪ��H2(g)��Cl2(g)==2HCl(g)��H����183 kJ/mol
D. �˷�Ӧ���Ȼ�ѧ����ʽΪ��1/2H2(g)��1/2Cl2(g)==HCl(g)��H����91.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣�ش��������⣺
I.CO�����ڸ�¯��������֪
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) ��H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) ��H2=bkJ/mol
��ӦFe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)����H3=_________kJ/mol(�ú�a��b�Ĵ���ʽ��ʾ)
��.һ�������£�CO2��CO���Ի���ת����
��1��ij�¶��£����ݻ�Ϊ2L���ܱ��������ס������ַ�ʽͶ�뷴Ӧ�����Ӧ��CO2(g)+H2(g) ![]() CO(g)+H2O(g)��
CO(g)+H2O(g)��
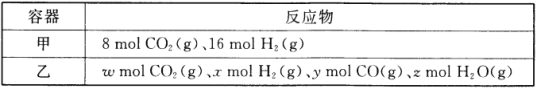
������15min��ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����0~15min��ƽ����Ӧ����v(H2)= _________���������¸÷�Ӧ��ƽ�ⳣ��K=_________��
��ʹƽ������������ͬ�����������������ȣ����ء�x��y��z������Ĺ�ϵ��_________����_________ (�ú�y�ĵ�ʽ��ʾ)��
��2���о��������¶ȡ�ѹǿ�Է�Ӧ��C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ��H�����ұ���ƽ��ת����Ӱ������ͼ��ʾ��
C6H5CH=CH2(g)+CO(g)+H2O(g) ��H�����ұ���ƽ��ת����Ӱ������ͼ��ʾ��
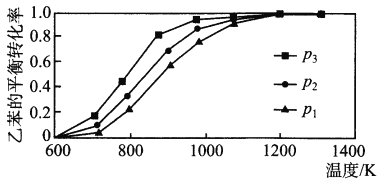
����H_________ 0(����>����<������=��)��ѹǿp1��p 2��p3�Ӵ�С��˳����_________��
��3��CO�ɱ�NO2������CO+NO2![]() CO2+NO�����¶ȸ���225��ʱ����Ӧ����v��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ_________��
CO2+NO�����¶ȸ���225��ʱ����Ӧ����v��=k����c(CO)��c(NO2)��v��=k����c(CO2)��c(NO)��k����k���ֱ�Ϊ�����淴Ӧ���ʳ������������¶ȷ�Χ�ڣ�k����k����÷�Ӧ��ƽ�ⳣ��K֮��Ĺ�ϵΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ����
A. HCl��NaOH��Ӧ���к��ȡ�H����57.3 kJ��mol1����H2SO4��Ca(OH)2��Ӧ���к��ȡ�H=2��(��57.3)kJ��mol1
B. ����ı�ȼ���Ȧ�H����890.3 kJ��mol1����CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����890.3 kJ��mol1
C. ��֪��500�桢30MPa�£�N2(g)��3H2(g)![]() 2NH3(g) ��H����92.4kJ��mol��1����1.5 mol H2������N2�ڴ������³�ַ�Ӧ���ų�����46.2 kJ
2NH3(g) ��H����92.4kJ��mol��1����1.5 mol H2������N2�ڴ������³�ַ�Ӧ���ų�����46.2 kJ
D. CO(g)��ȼ������283.0kJ��mol1����2CO2(g) ===2CO(g)+O2(g)��Ӧ�ġ�H��+566.0 kJ��mol1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com