
【题目】如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
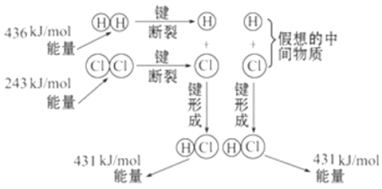
A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
序号 | a | b | c | d | e | f |
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为________。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是________________(用离子方程式表示)。
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有__(填字母代号)。
A.pH=8. 8的NaOH溶液
B.pH=5. 2的NH4Cl溶液
C.pH=5. 2的盐酸
D.0. 1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有_____。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B.2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A. 在自然界中只以化合态的形式存在
B. 单质常用作左半导体材料和光导纤维
C. 最高价氧化物不与酸反应
D. 气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
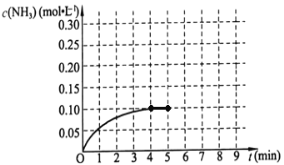
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)利用反应CuSO4+Fe===Cu+FeSO4可设计为原电池。
(1)负极材料是________(写名称),电极反应为__________________________________。
(2)正极电极反应式为______________________。
(3)溶液中SO42-向________极移动。
(II)工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。
(4)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总理论数值,其原因是____________________________。
(5)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(6)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.反应达到最大限度 d.N2和H2的浓度相等
e.生成1 mol N2的同时,消耗2 mol NH3 f.生成3 mol H2的同时,生成2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. NaHS水解反应:HS-+H2O ![]() H3O++S2-
H3O++S2-
B. Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O
C. 过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3-
D. Na2CO3水溶液中存在平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 浓度均为lmol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH和CH3COO—的总数为2NA
B. 1molP4所含共价键数目为4mol
C. 1 mol K2S与K2S2的混合物中含离子总数为3NA
D. 25 ℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合忽略体积变化;计算结果保留到小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入_________mL。
(2)若用pH=2的盐酸,应加入_________mL。
(3)若用水稀释,则加入水的体积为____________________ mL。
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=11的NaOH溶液中由水电离出的H+浓度为c2,则c1/c2=_________。
(5)常温下,pH=11的NaOH溶液aL与pH=5的H2SO4溶液bL混合,若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com