
【题目】常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
序号 | a | b | c | d | e | f |
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为________。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是________________(用离子方程式表示)。
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有__(填字母代号)。
A.pH=8. 8的NaOH溶液
B.pH=5. 2的NH4Cl溶液
C.pH=5. 2的盐酸
D.0. 1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有_____。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B.2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为__________。
【答案】CH3COO-AlO-+2H2O![]() Al(OH)3+OH-BEBDEc(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
Al(OH)3+OH-BEBDEc(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
【解析】
(1)弱酸根离子水解程度越小,相同浓度的钠盐溶液的pH越小,则酸根离子结合质子能力越小;
(2)NaAlO2为强碱弱酸盐,水解呈碱性;
(3)酸或碱抑制了水的电离,含有弱离子的盐促进水电离,据此对各选项进行判断;
(4)任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
(5)0.2mol/LHCl与0.1mol/L NaAlO2溶液等体积混合,设体积都为1L,反应后生成Al(OH)3和Al3+。
(1)相同浓度的钠盐溶液,pH越小则盐的水解程度越小,阴离子结合H+能力最弱的就是弱酸根对应的酸酸性最强的。酸性强弱CH3COOH>H2CO3>HClO>HCN>HAlO2,所以阴离子结合H+能力最弱的为CH3COO-,
因此,本题正确答案为:CH3COO-;
(2)NaAlO2是强碱弱酸盐,AlO-水解使溶液显碱性,AlO-+2H2O![]() Al(OH)3+OH-,
Al(OH)3+OH-,
因此,本题正确答案为:AlO-+2H2O![]() Al(OH)3+OH-;
Al(OH)3+OH-;
(3)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=![]() =10-5.2mol/L,
=10-5.2mol/L,
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L,不符合题意;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L,符合题意;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=![]() =10-8.8mol/L,不符合题意;
=10-8.8mol/L,不符合题意;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L,不符合题意;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离的c(OH-)=![]() =10-5.2mol/L,符合题意;
=10-5.2mol/L,符合题意;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:BE,
因此,本题正确答案为:BE;
(4)将浓度均为0. 1 mol/L的NaHCO3、Na2CO3等体积混合,混合溶液中粒子之间符合电荷守恒,物料守恒和质子守恒。NaHCO3溶液有物料守恒:c(Na+)=c(CO32-) +c(HCO3-) +c(H2CO3);Na2CO3溶液有c(Na+)=2 c(CO32-) +2 c(HCO3-) +2 c(H2CO3);二式相加即2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3);B正确。电荷守恒c(Na+) +c(H+) = 2 c(CO32-) + c(HCO3-) +c(OH-)D正确;
CO32-)水解程度大于HCO3-,溶液呈碱性,所以有c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+),E正确。
(5)0.2mol/LHCl与0.1mol/L NaAlO2溶液等体积混合,设体积都为1L,反应后生成Al(OH)3和Al3+,其中Al3+为![]() mol,Al3+水解呈酸性,离子浓度大小顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),
mol,Al3+水解呈酸性,离子浓度大小顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),
因此,本题正确答案为:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向恒温、恒容(2L)的密闭容器中充入2molSO2和一定量的O2发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
A. 达到平衡时再充入2mol SO2反应的△H保持不变。
B. 用O2表示4min内的反应速率为0.1mol·(L·min)-1
C. 再向容器中充入1mol SO3,达到新平衡,n(SO2)∶n(O2)=2∶1
D. 4min后,若升高温度,平衡向逆反应方向移动,平衡常数K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
B. 已知0.1 mol·L-1 二元酸H2A溶液的pH=4,则在0.1 mol·L-1 Na2A溶液中:c(OH-) = c(HA-) + c(H+) + 2c(H2A)
C. 将0.1 mol·L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3.H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是( )
|
|
|
|
A.制取少量CO2,可随开随制,随关随停 | B.配制一定物质的量浓度的稀硫酸 | C.可制得Fe(OH)2,并观察其颜色 | D. 干燥、收集NH3,并吸收多余的尾气 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B. 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-a kJ/mol
II: ![]()
且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )
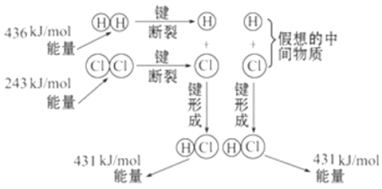
A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com