
【题目】向恒温、恒容(2L)的密闭容器中充入2molSO2和一定量的O2发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
A. 达到平衡时再充入2mol SO2反应的△H保持不变。
B. 用O2表示4min内的反应速率为0.1mol·(L·min)-1
C. 再向容器中充入1mol SO3,达到新平衡,n(SO2)∶n(O2)=2∶1
D. 4min后,若升高温度,平衡向逆反应方向移动,平衡常数K增大
【答案】D
【解析】
A. △H 与化学反应方程式的计量数有关,与加入反应物的量无关,所以2SO2(g)+O2(g) ![]() 2SO3(g) △H = —197.74KJ.mol-1达到平衡时再充入2mol SO2反应△H不会发生改变;故A正确;B. 4min 后达到平衡,二氧化硫平均速率:v(SO2)=(2mol/2L-0.2mol.L-1)/4min=0.2 mol·(L·min)-1,根据化学反应速率之比等于化学方程式系数之比, SO2(g)与O2(g)计量数之比为2:1,所以4min内O2的反应速率为0.1mol·(L·min)-1,故B正确;C、根据计算可以知道起始量二氧化硫和氧气物质的量之比为2:1,平衡状态下再加入1mol三氧化硫,根据元素守恒达到平衡后n(SO2)∶n(O2)=2∶1,故C正确;D、反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,故D错误;答案:D。
2SO3(g) △H = —197.74KJ.mol-1达到平衡时再充入2mol SO2反应△H不会发生改变;故A正确;B. 4min 后达到平衡,二氧化硫平均速率:v(SO2)=(2mol/2L-0.2mol.L-1)/4min=0.2 mol·(L·min)-1,根据化学反应速率之比等于化学方程式系数之比, SO2(g)与O2(g)计量数之比为2:1,所以4min内O2的反应速率为0.1mol·(L·min)-1,故B正确;C、根据计算可以知道起始量二氧化硫和氧气物质的量之比为2:1,平衡状态下再加入1mol三氧化硫,根据元素守恒达到平衡后n(SO2)∶n(O2)=2∶1,故C正确;D、反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,故D错误;答案:D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NH4HSO4 在分析试剂、医药、电子工业中用途广泛。室温时,向100mL0.lmol·L-1 NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH 与NaOH 溶液体积的关系曲线如图所示。下列说法正确的是
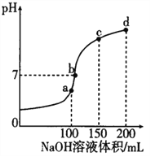
A. a点溶液中:c(NH4+)+c(H+)=c(Na+) +c(OH-)
B. c点溶液中:c(SO42-)>c(NH3·H2O)>c(NH4+)
C. d点溶液中:c(SO42-) >c(NH4+)>c(OH-)
D. a、b、c、d 四个点中,b点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
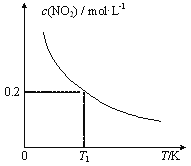
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L时,则平衡时H2的浓度(mol/L)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L时,则平衡时H2的浓度(mol/L)是
A. 0.16 B. 0.08 C. 0.06 D. 0.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
A.镁在空气中燃烧,生成白色固体氧化镁
B.木炭在氧气中燃烧,发出白色火焰,放热,生成黑色固体
C.铜片在空气中加热,观察到铜片表面变黑
D.硫在空气燃烧,发出明亮的蓝紫色火焰,生成一种有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Am+和Bn-具有相同的核外电子排布,且A原子的质子数为X,则B原子的质子数为( )
A.X-m-nB.X+m+nC.X+m-nD.X-m+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲大量配制含有下列四种不同阴、阳离子的溶液,其中能配制成功的是
A. K+、H+、Cl-、CO32- B. Mg2+、Al3+、Cl-、SO42-
C. Na+、H+、NO3-、Fe2+ D. Na+、Ba2+、HCO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
序号 | a | b | c | d | e | f |
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
pH | 8. 8 | 9. 7 | 11. 6 | 10. 3 | 11. 1 | 11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为________。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是________________(用离子方程式表示)。
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有__(填字母代号)。
A.pH=8. 8的NaOH溶液
B.pH=5. 2的NH4Cl溶液
C.pH=5. 2的盐酸
D.0. 1 mol/L的NaCN溶液
E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有_____。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B.2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C.c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D.c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com