
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一密闭容器中进行,下列条件的改变能使反应速度变快的是①体积不变,增加Fe的量; ②体积不变,增加H2O的量;③体积不变,充入N2使压强增大;④压强不变,充入N2使体积增大
Fe3O4(s)+4H2(g)在一密闭容器中进行,下列条件的改变能使反应速度变快的是①体积不变,增加Fe的量; ②体积不变,增加H2O的量;③体积不变,充入N2使压强增大;④压强不变,充入N2使体积增大
A. ①②③B. ②④C. ②③D. ②
科目:高中化学 来源: 题型:
【题目】下列各种说法中不正确的是![]()
![]()
A. 在水中氢、氧原子间均以共价键相结合
B. 离子键是阳离子、阴离子的静电作用
C. ![]() 和
和![]() 的反应过程涉及了共价键的断裂和形成
的反应过程涉及了共价键的断裂和形成
D. 金属具有金属光泽及良好的导电性和导热性,这些性质均与金属键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物在生产与生活中有重要的意义。工业上制备无水FeCl3的一种工艺如下:

(1)吸收塔中吸收剂X是 ____________________。
(2)温度超过673 K,捕集器中的物质相对分子质量为325,该物质的化学式为______是__________________ (填’“离子化合物”或“共价化合物”)
(3)从FeCl3溶液中获得FeCl3·6H2O的方法是__________________________。
(4)向饱和氯化铁溶液中加入足量的氢氧化钠溶液后再加入次氯酸钠可制备高铁酸钠Na2FeO4溶液。写出制备高铁酸钠的离子方程式:________________________
(5)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是______________________。
(6)高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。则高铁放电时,____(填“正”或“负”)极附近溶液的碱性增强。电池正极反应为_________________
3Zn(OH)2+2Fe(OH)3+4KOH。则高铁放电时,____(填“正”或“负”)极附近溶液的碱性增强。电池正极反应为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识解答问题:
![]() 在高温下CuO能分解生成
在高温下CuO能分解生成![]() ,试从原子结构角度解释其原因: ______
,试从原子结构角度解释其原因: ______ ![]() 根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 ______ 区
根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 ______ 区![]()
![]() 氰酸
氰酸![]() 是一种链状分子,它与异氰酸
是一种链状分子,它与异氰酸![]() 互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ______
互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ______ ![]() 其中的C的杂化类型为 ______ .
其中的C的杂化类型为 ______ .
![]() 原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物
原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物![]() 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ______ .
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ______ .
![]() 立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 ______ 个氮原子, ______ 个硼原子,设氮原子半径为apm,硼的原子半径bpm,求该晶胞的空间利用率 ______
立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 ______ 个氮原子, ______ 个硼原子,设氮原子半径为apm,硼的原子半径bpm,求该晶胞的空间利用率 ______ ![]() 用含a、b的代数式表示
用含a、b的代数式表示![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c( )
)
A. a、b、c均能与溴水发生加成反应
B. a、b、c的分子式均为C8H8
C. a的所有原子一定处于同一一平面
D. b的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的说法中,正确的是( )
A. 热稳定性:Na2CO3<NaHCO3
B. Na2CO3和NaHCO3均可与澄清石灰水反应
C. 相同温度下,在水中Na2CO3的溶解度小于NaHCO3
D. 106 g Na2CO3和84 g NaHCO3分别与过量盐酸反应,放出CO2的质量:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据信息填空:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3 +Cu ===2FeCl2 +CuCl2,若将此反应设计成原电池,则负极所用的电极材料为____;当线路中转移0.2mol电子时,则被腐蚀的铜的质量为____。
(2)如图所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,可观察到溶液变浑浊,试回答下列问题:
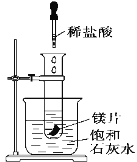
①产生上述现象的原因是___________________________;
②写出有关反应的离子方程式___________________。
③由实验推知,MgCl2和H2的总能量__________(填“大于”、“小于”或“等于”)Mg和HCl的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KBr和NaI的混合溶液中通人过量的C12充分反应。将溶液蒸干,并灼烧所得的最后剩余的固体物质是( )
A.NaCl和KClB.KCl与NaBr
C.NaCl和KID.NaCl、KCl与I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com