
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
分析 A、氢氧化钠是强电解质,一水合氨是弱电解质,相同浓度的两种溶液中,氢氧化钠溶液的pH大于氨水,加水稀释促进一水合氨电离,但一水合氨仍然存在电离平衡;
B、c(H+)=10-pH;
C、醋酸是弱酸,越稀越电离;
D、弱电解质的电离平衡常数只与温度有关.
解答 解:A、氢氧化钠是强电解质完全电离,一水合氨是弱电解质,在水溶液里部分电离,相同浓度的两种溶液中,氢氧化钠溶液的pH大于氨水,加水稀释促进一水合氨电离,但一水合氨仍然存在电离平衡,电离程度仍然小于氢氧化钠,所以要使稀释后溶液的PH相等,则氢氧化钠需要稀释倍数大于氨水,即m>n,故A错误;
B、c(H+)=10-pH,故pH=a的氨水溶液中氢离子浓度为10-amol/L,pH=a+1的乙酸溶液中的氢离子浓度为10-(a+1)mol/L,故甲乙两溶液c(H+)之比为10:1,故B正确;
C、醋酸是弱酸,越稀越电离,故0.2 mol•L-1乙酸溶液的电离程度小于0.1 mol•L-1乙酸溶液的电离程度,故c(H+)之比小于2:1,故C错误;
D、弱电解质的电离平衡常数只与温度有关,温度不变是,醋酸的电离平衡常数不变,但稀释醋酸溶液时促进醋酸电离,导致醋酸的电离度增大,故D错误.
故选B.
点评 本题考查了弱电解质的电离、影响弱电解质电离的因素等知识点,明确弱电解质电离特点是解本题关键,注意电离平衡常数、水解平衡常数、化学平衡常数、溶度积常数等都只与温度有关,与溶液的酸碱性无关,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
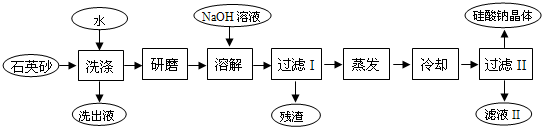
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
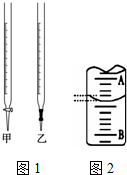 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
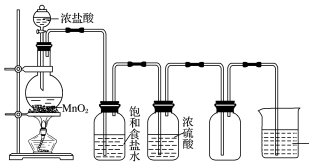
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A | |
| B. | B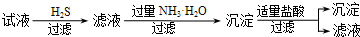 | |
| C. | C | |
| D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com