
分析 等体积混合0.1mol•L-1的盐酸和0.06mol•L-1的Ba(OH)2溶液混合,发生H++OH-=H2O,反应后OH-过量,假设体积都为1L,则混合体积为2L,计算c(OH-),可计算pH.
解答 解:假设体积都为1L,则1L0.1mol•L-1的盐酸中n(H+)=0.1mol,1L0.06mol•L-1的Ba(OH)2溶液n(OH-)=0.12mol,
等体积混合发生H++OH-=H2O,
反应后c(OH-)=$\frac{0.12mol-0.1mol}{2L}$=0.01mol/L,则pH=12.
答:混合后溶液的pH为12.
点评 本题考查溶液pH的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,把握反应的关系,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
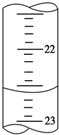 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
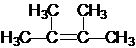 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯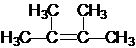 →
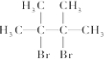
→
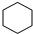 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
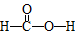 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: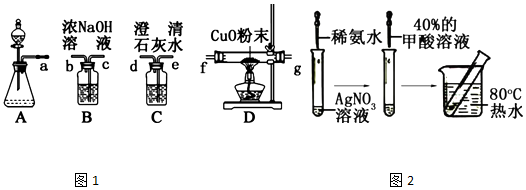
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | |
| D. | 锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com