
【题目】常温下,向100 mL 0.l mol.L-lHCl的溶液中逐滴加入0. 2 mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计)。下列说法中正确的是( )

A.MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.在K点,c(M+)>c(Cl-)>c(OH-)>c(H+)
D.K点对应的溶液中,有c( MOH) +c( M+)=0.2 mol![]() L-1
L-1
【答案】C
【解析】
A、0.1mol/L HCl溶液中pH=1,N点时溶液呈中性,MOH的物质的量大于HCl的物质的量,说明MOH是弱碱,错误;
B、N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,B错误;
C、K点所示溶液中,l00mL 0.1mol/L HCl的溶液中逐滴加入0.2mol/L MOH溶液100ml,反应后溶液中含有MOH、MCl溶液,显示碱性,c(OH-)>c(H+),则c(Cl-)<c(M+),所以c(M+)>c(Cl-)>c(OH-)>c(H+),C正确;
D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)和c(M+)的和是原来MOH浓度的一半,有c(MOH)+c(M+)=0.1 mol/L,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2 ③![]() ④ CH3CH3
④ CH3CH3
A. ①②③④B. ③④
C. ①②④D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂, v(正)v(逆)都发生变化,而且变化的倍数相等
B.加压, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.升温, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
D.加入氩气,v(正)v(逆)都不变,且v(正)等于v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
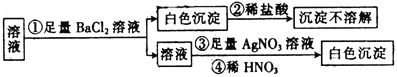
A.原溶液中一定只含有SO![]()
B.原溶液中一定含有SO![]() 和Cl-
和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有SO![]() ,也可能含有Cl-
,也可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既不是水解反应,又不是氧化还原反应的是( )
A.Cl2+H2O![]() HCl+HClOB.H2S+H2O
HCl+HClOB.H2S+H2O![]() H3O++HS-
H3O++HS-
C.HCO![]() +H2O
+H2O![]() H2CO3+OH-D.NH
H2CO3+OH-D.NH![]() +H2O
+H2O![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L Cr2O72-含量为108mgL-1的含铬废水,至少需要______L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),需调节溶液pH______。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考察反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000molL-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g) ![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
A.c(X2)=0.15 mol/LB.c(Y2)=0.9 mol/L
C.c(Z2)=0.3 mol/LD.c(Q2)=0.54 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)="0.100" mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B. c(Na+)="0.100" mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)>2c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com