
【题目】在一定条件下,可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂, v(正)v(逆)都发生变化,而且变化的倍数相等
B.加压, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.升温, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
D.加入氩气,v(正)v(逆)都不变,且v(正)等于v(逆)
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形的分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
⑴这四种元素中电负性最大的元素的基态原子的价电子排布图为______.
⑵由A与B两种元素形成的化合物中,其中B原子采用sp杂化的最简单化合物分子中,含有的δ键、π键数目之比为______.
⑶D元素的常见离子的水溶液显色的原因是______,此离子中存在的化学键有______(a.离子键b.共价键c.配位键d.氢键e.范德华力f.金属键![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
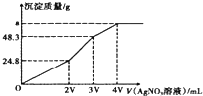
A.所加AgNO3溶液的物质的量浓度为![]() mol/L
mol/L
B.a的数值为62.65
C.常温下,AgCl,AgI,Ag2S在水中溶解能力依次减小
D.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配制氯化亚铁溶液时要加入一定量的盐酸,目的是______________________;还要加入少量铁粉,目的是_______________________。(以上用相应的离子方程式解释)
(2)把下列溶液蒸干并灼烧,用所得物质的化学式填空:Na2CO3溶液___________; NaClO溶液___________; AlCl3溶液____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3_____________________;
(2) ______________________;
______________________;
(3) __________________;
__________________;
(4) ________________________;
________________________;
(5) ____________________________;
____________________________;
(6)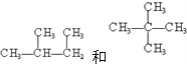 ________________________________;
________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.l mol.L-lHCl的溶液中逐滴加入0. 2 mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计)。下列说法中正确的是( )

A.MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.在K点,c(M+)>c(Cl-)>c(OH-)>c(H+)
D.K点对应的溶液中,有c( MOH) +c( M+)=0.2 mol![]() L-1
L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体 ③调节液面至“0”或“0”刻度线以下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。 请回答:
⑴以上步骤有错误的是(填编号)______,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________
⑵下列选项将导致测定结果偏小的是___________
A.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
B.滴定到终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑶判断滴定终点的现象是:__________________________________________________________
⑷下图是某次滴定时的滴定管中的液面,其读数为 ___________mL
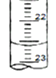
⑸根据下列数据:请计算待测盐酸溶液的浓度:__________mol/L
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com