
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形的分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
⑴这四种元素中电负性最大的元素的基态原子的价电子排布图为______.
⑵由A与B两种元素形成的化合物中,其中B原子采用sp杂化的最简单化合物分子中,含有的δ键、π键数目之比为______.
⑶D元素的常见离子的水溶液显色的原因是______,此离子中存在的化学键有______(a.离子键b.共价键c.配位键d.氢键e.范德华力f.金属键![]()
【答案】![]() 3:2 形成了四水合铜离子 bc
3:2 形成了四水合铜离子 bc
【解析】
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为Cu元素;结合原子序数可知,C只能处于第三周期,B(碳元素![]() 与C可形成正四面体型分子,该化合物为四氯化碳,则C为Cl元素。
与C可形成正四面体型分子,该化合物为四氯化碳,则C为Cl元素。
⑴四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5,其基态原子的价电子排布图为:![]() ,故答案为:
,故答案为:![]() 。
。
⑵A、B分别为H、C元素,C原子采用sp杂化的最简单化合物为CH![]() CH,碳碳双键中含有2个π键、1个δ键,则乙炔分子中含有的3个δ键、2个π键,含有的δ键、π键数目之比=3:2,故答案为:3:2。
CH,碳碳双键中含有2个π键、1个δ键,则乙炔分子中含有的3个δ键、2个π键,含有的δ键、π键数目之比=3:2,故答案为:3:2。
⑶D为Cu元素,铜离子溶于水形成[Cu(H2O)4]2+,所以其水溶液显色,[Cu(H2O)4]2+离子中,Cu与O元素间形成配位键,H与O之间形成共价键,故答案为:形成了四水合铜离子;bc。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和实验结论均正确且前后相匹配的是
选项 | 实验操作 | 现象 | 结论 |
A | 向含等物质的量浓度的 | 先生成黑色沉淀,静置,继续滴加 |
|
B | 向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制备的 | 无砖红色沉淀产生 | 蔗糖未水解 |
C | 向氯水中滴加紫色石蕊试液 | 溶液变为红色,且长时间内颜色无变化 | 氯水显酸性 |
D | 将少量硼酸溶液滴入碳酸钠溶液中 | 无气泡产生 | 酸性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
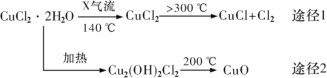
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把6 mol A和5 mol B通入容积为4L的恒容密闭容器中发生反应3A(g)+B(g)![]() 2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是
2C(g)+2D(g),反应经过5min达到平衡,此时生成2 mol C,正反应速率(v正)和逆反应速率(v逆)随时间(t)的变化如图所示。下列说法正确的是

A.t2=5min,平衡时3v正(A)=2v逆(D)
B.0~t2,A的平均反应速率为0.15 mol·L-1·min-1
C.t2~t3,各物质的浓度一定相等
D.B的平衡转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0064 mol/(L·s)
B.若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的△H﹤0
C.相同温度下,起始时向该容器中充入 4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于 80%
D.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素。A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能。E是第四期第IB族元素,回答下列问题:
A | B | |
D |
⑴E原子的基态电子排布式 ______;
⑵A、B、C三种元素的第I电离能由大到小的顺序是 ______;
⑶D能形成多种价态的含氧酸,其酸性由强到弱的顺序为 ______;
⑷已知金属C单质的晶胞为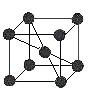 ,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
⑸向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为![]() 写真实符号
写真实符号![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素。已知:①F的单质为生活中最常见的金属之一,原子最外层有2个电子;②E原子的价电子排布为msnmpn,B原子的核外L层电子数为奇数;③A、D原子p轨道的电子数分别为2和4.请回答下列问题:
(1)F的稳定价态离子的电子排布式是__________________________;A、B、D、E四种元素的第一电离能由大到小的顺序为________________(用元素符号表示)。
(2)对于B的简单氢化物,其中心原子的轨道杂化类型是________________。分子的立体构型为________________,该氢化物易溶于D的简单氢化物的主要原因是________________。
(3)D原子分别与A、B原子形成的单键中,键的极性较强是________________(用具体的化学键表示)。
(4)如图所示的晶胞是由AD两元素组成的,下列有关该晶体的说法中正确的是_______。

a.该晶体的化学式为AD
b.该晶体中A、D原子间形成的是双键
c.该晶体熔点可能比SiO2晶体高
d.该晶体可溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是
①SO2 ②CH3CH2CH=CH2 ③![]() ④ CH3CH3
④ CH3CH3
A. ①②③④B. ③④
C. ①②④D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂, v(正)v(逆)都发生变化,而且变化的倍数相等
B.加压, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.升温, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
D.加入氩气,v(正)v(逆)都不变,且v(正)等于v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com