
【题目】A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素。A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能。E是第四期第IB族元素,回答下列问题:
A | B | |
D |
⑴E原子的基态电子排布式 ______;
⑵A、B、C三种元素的第I电离能由大到小的顺序是 ______;
⑶D能形成多种价态的含氧酸,其酸性由强到弱的顺序为 ______;
⑷已知金属C单质的晶胞为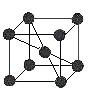 ,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
⑸向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为![]() 写真实符号
写真实符号![]() ______。
______。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 N > O > Na HClO4 > HClO3 > HClO2 > HClO 体心立方堆积 8 [Cu(NH3)4]2+
【解析】
A的价层电子排布为ns2np3,即A为第ⅤA族元素,根据A、B、D在周期表的位置可知,D为Cl,B为O,A为N,C的基态原子的第I电离能远小于第II电离能,即C最外层只有一个电子,所以C为第ⅠA族元素,A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,所以C为Na,E是第四期第IB族元素,则E为Cu。
⑴E为Cu,是29号元素,其原子的基态电子排布式为1s22s22p63s23p63d104s1或[Ar] 3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1。
⑵N、O、Na三种元素中,由于N原子最外层是半满结构,所以第I电离能N > O,Na是金属元素,第一电离能较小,所以N、O、Na第一电离能由大到小的顺序是N > O > Na,故答案为:N > O > Na。
⑶D为Cl,D能形成多种价态的含氧酸,其酸性由强到弱的顺序为HClO4 > HClO3 > HClO2 > HClO,故答案为:HClO4 > HClO3 > HClO2 > HClO。
⑷根据金属Na单质的晶胞图可知,钠原子位于晶胞的顶点和体心,则Na原子的堆积方式为体心立方堆积,每个Na原子周围距离最近的Na原子数为8,所以Na原子的配位数是8,故答案为:体心立方堆积;8。
⑸E、D形成的稳定化合物溶液为氯化铜溶液,向其中不断加入氨气的水溶液,最后会形成铜氨配合离子,铜元素的最主要存在形式为[Cu(NH3)4]2+,故答案为:[Cu(NH3)4]2+。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
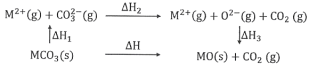
下列说法正确的是
A.△H1(CaCO3)>△H1(MgCO3)>0
B.△H2(MgCO3)>△H2(CaCO3)>0
C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO)
D.对于MgCO3和CaCO3,△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形的分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
⑴这四种元素中电负性最大的元素的基态原子的价电子排布图为______.
⑵由A与B两种元素形成的化合物中,其中B原子采用sp杂化的最简单化合物分子中,含有的δ键、π键数目之比为______.
⑶D元素的常见离子的水溶液显色的原因是______,此离子中存在的化学键有______(a.离子键b.共价键c.配位键d.氢键e.范德华力f.金属键![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
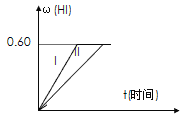
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。
(1)下列关于烃A和烃B的说法中不正确的是_____(填字母编号)。
a、烃A和烃B可能互为同系物
b、烃A和烃B可能互为同分异构体
c、当m=12时,烃A一定为烷烃
d、当n=11时,烃B可能的分子式有两种
e、烃A和烃B可能都为芳香烃
(2)若烃A为链状烃,且分子中所有碳原子都在一条直线上,则A的结构简式为____。
(3)若烃A为链状烃,分子中所有碳原子不可能都在同一平面上。在一定条件下,1mol A最多只能与1mol H2发生加成反应。写出烃A的名称:_______。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量浓硫酸,浓硫酸增重1.26g,再通过足量碱石灰,碱石灰增重4.4g,则烃B的分子式为______。
(5)有机物CH3CH(C2H5)CH(CH3)(CH2)3 CH3的系统命名是_______,1mol该有机物完全燃烧需消耗标准状况下氧气___L。
(6)请写出下列化合物所含官能团的名称:
①CH3CH=CH2:______; ②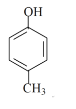 :______; ③
:______; ③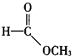 :______。
:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:

下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B. 母液中的溶质是K2CO3、KHCO3、KCl
C. “结晶”环节采用加热蒸发结晶的方法
D. “转化”反应中,生成的KMnO4和MnO2的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配制氯化亚铁溶液时要加入一定量的盐酸,目的是______________________;还要加入少量铁粉,目的是_______________________。(以上用相应的离子方程式解释)
(2)把下列溶液蒸干并灼烧,用所得物质的化学式填空:Na2CO3溶液___________; NaClO溶液___________; AlCl3溶液____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com