
【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体 ③调节液面至“0”或“0”刻度线以下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。 请回答:
⑴以上步骤有错误的是(填编号)______,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________
⑵下列选项将导致测定结果偏小的是___________
A.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
B.滴定到终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑶判断滴定终点的现象是:__________________________________________________________
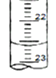
⑷下图是某次滴定时的滴定管中的液面,其读数为 ___________mL
⑸根据下列数据:请计算待测盐酸溶液的浓度:__________mol/L
滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
【答案】① 偏大 A 当滴入最后一滴NaOH溶液时,溶液由无色变为粉红(浅红)色,且半分钟内溶液颜色不恢复 22.60 0.2000 mol·L-1
【解析】
(1)①滴定管先用水洗,再用待盛液润洗;
⑵根据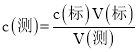 分析误差;
分析误差;
⑶滴定终点时,溶液由无色变为粉红色;
⑷滴定管读数精确到0.01mL;
⑸根据表格数据,第三次实验数据超出误差范围,所以根据第一次、第二次实验数据计算消耗氢氧化钠的平均体积,带入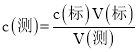 计算盐酸浓度。
计算盐酸浓度。
(1)滴定管水洗后需再用待装液润洗,所以①错误;若不用待装液润洗,会使滴定管中溶液浓度偏低,消耗溶液体积偏大,使测定结果偏大;
⑵A.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,消耗氢氧化钠的体积偏小,测定结果偏小,故选A;
B.滴定到终点读数时,仰视滴定管的刻度,消耗氢氧化钠的体积偏大,测定结果偏大,故不选B;
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,盐酸物质的量增多,消耗氢氧化钠的体积偏大,测定结果偏大,故不选C;
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,消耗氢氧化钠的体积偏大,测定结果偏大,故不选D;
故答案选A;
⑶判断滴定终点的现象是:当滴入最后一滴NaOH溶液时,溶液由无色变为粉红(浅红)色,且半分钟内溶液颜色不恢复;
⑷根据图示,滴定管中的液面读数为22.60mL;
⑸根据表格数据,第三次实验数据超出误差范围,所以根据第一次、第二次实验数据,消耗氢氧化钠的平均体积是20.00mL, 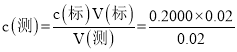 =0.2000 mol·L-1。
=0.2000 mol·L-1。


科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) △H<0达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂, v(正)v(逆)都发生变化,而且变化的倍数相等
B.加压, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.升温, v(正)v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
D.加入氩气,v(正)v(逆)都不变,且v(正)等于v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g) ![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
A.c(X2)=0.15 mol/LB.c(Y2)=0.9 mol/L
C.c(Z2)=0.3 mol/LD.c(Q2)=0.54 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色混合气体中可能含有![]() 、CO、
、CO、![]() 、
、![]() 气
气![]() 中的一种或几种,依次进行如下处理
中的一种或几种,依次进行如下处理![]() 假定每次处理均反应完全
假定每次处理均反应完全![]() :(1)通过碱石灰时,气体体积变小;(2)通过赤热的氧化铜时,固体变为红色;(3)通过无水硫酸铜粉末时,粉末变为蓝色;(4)通过澄清石灰水时,溶液变浑浊。由此可以确定原混合气体中
:(1)通过碱石灰时,气体体积变小;(2)通过赤热的氧化铜时,固体变为红色;(3)通过无水硫酸铜粉末时,粉末变为蓝色;(4)通过澄清石灰水时,溶液变浑浊。由此可以确定原混合气体中
A.一定含有![]() 、
、![]() ,可能含有
,可能含有![]() 、CO
、CO
B.一定含有![]() 、CO,可能含有
、CO,可能含有![]() 、
、![]()
C.一定含有CO、![]() ,可能含有
,可能含有![]() 、
、![]()
D.一定含有CO、![]() ,至少含有
,至少含有![]() 、
、![]() 的一种
的一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来食品安全问题成为社会各界日益关注的焦点话题.香港地区食环署食物安全中心曾对十五个桂花鱼样本进行化验,结果发现十一个样本中含有孔雀石绿。孔雀石绿是化工产品,具有较高毒性,高残留,且长期服用后,容易致癌、致畸,对人体有害。其结构简式如图所示。下列关于孔雀石绿的说法正确的是( )
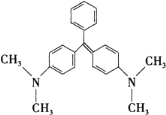
A.孔雀石绿的分子式为C23H25N2
B.1mol孔雀石绿在一定条件下最多可与6molH2发生加成反应
C.孔雀石绿属于芳香烃
D.孔雀石绿苯环上的一氯取代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)="0.100" mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B. c(Na+)="0.100" mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)>2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可丁是一种药物,该药物适用于刺激性干咳病人服用,无成瘾性,化合物H是制备该药物的重要中间体,合成路线如下:
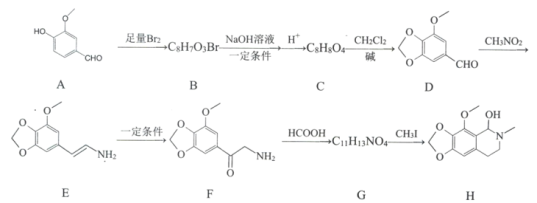
已知:①
②RNH2 ![]() RNHCH3
RNHCH3
(1)化合物B的结构简式:________。
(2)反应B→C的第一步反应类型:____________。
(3)下列说法正确的是:___________。
A 物质D能与FeCl3发生显色反应 B 物质F具有碱性
C 物质G能和银氨溶液发生反应 D 物质H的分子式是C12H15NO4
(4)写出C→D的化学方程式:____________。
(5)请写出化合物H满足下列条件的所有同分异构体的结枸简式:_______________。
①分子中含苯环,无其他环状结构
②分子中含有NO2且直接连在苯环上
③分子中只有3种不同化学环境的氢
(6)已知CH2=CHCH3![]() CH2CHCH2Cl,请以
CH2CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() ,写出制备的合成路线流程图(无机试剂任选)______________。
,写出制备的合成路线流程图(无机试剂任选)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com