
����Ŀ�� ��һ��ҽѧ�м��壬�������Ʊ�����Ѫҩ����ͨ������·�ߺϳɣ�
��һ��ҽѧ�м��壬�������Ʊ�����Ѫҩ����ͨ������·�ߺϳɣ� 
�ش��������⣺
��1��A��������������ͭ������Ӧ����ש��ɫ������A�Ľṹ��ʽ�� ��
��2��B�ĺ��������ŵ������� �� C+E��F�ķ�Ӧ������ ��
��3��F�ķ���ʽ�� �� �÷��ӵ�����ʺɱ�Ϊ ��
��4�����������������л����ͬ���칹�����֣���д��һ�ֵĽṹ��ʽa����F��Ϊͬ���칹��b��������c�����ڶ�Ԫ����d��������ֻ��һ��ȡ����
��5��д��G����NaOH��Һ����ʱ��Ӧ�Ļ�ѧ����ʽ��
��6�����й����������ʵ�������ȷ����������ţ�����1molD����2molNaHCO3��Һ��Ӧ
��E����FeCl3��Һ������ɫ��Ӧ
��B���������������ܸ��ݺ˴Ź�������������
��1molG�������5molH2�����ӳɷ�Ӧ��
���𰸡�
��1��CH3CHO
��2���Ȼ���ȡ����Ӧ
��3��C10H10O4��194
��4��3��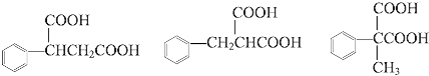 �е�����һ��
�е�����һ��
��5��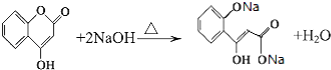
��6����
���������⣺A��������Һ��Ӧ���������ɣ���A�д���ȩ���������̿�֪��A��������Ӧ�����������ᣬ��AΪCH3CHO����B��C�Ľṹ��ʽ���Կ�������������е��ǻ�����ԭ��ȡ����������ȡ����Ӧ��D��״���Ũ���������·���������Ӧ����E��E�ĽṹΪ 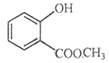 ����F�Ľṹ��ʽ��֪��C��E �ڴ�����������ȥһ��HCl���ӵõ�F��F�д����������ڼ�Һ�п��Է���ˮ�ⷴӦ����1����������ķ�����֪��AΪCH3CHO�����Դ��ǣ�CH3CHO����2������B�Ľṹ��ʽ��B�ĺ��������ŵ��������Ȼ�����C��E��F�Ľṹ��ʽ��֪��C��E����ȡ����Ӧ����F�����Դ��ǣ��Ȼ���ȡ����Ӧ����3������F�Ľṹ��ʽ��֪��F�ķ���ʽ��C10H10O4 �� �÷��ӵ���Է�������Ϊ194������������ʺɱ�Ϊ194�����Դ��ǣ�C10H10O4��194����4����������a����F��Ϊͬ���칹��b��������c�����ڶ�Ԫ����d��������ֻ��һ��ȡ���������F�Ľṹ��ʽ��֪�����������������л����ͬ���칹��Ϊ
����F�Ľṹ��ʽ��֪��C��E �ڴ�����������ȥһ��HCl���ӵõ�F��F�д����������ڼ�Һ�п��Է���ˮ�ⷴӦ����1����������ķ�����֪��AΪCH3CHO�����Դ��ǣ�CH3CHO����2������B�Ľṹ��ʽ��B�ĺ��������ŵ��������Ȼ�����C��E��F�Ľṹ��ʽ��֪��C��E����ȡ����Ӧ����F�����Դ��ǣ��Ȼ���ȡ����Ӧ����3������F�Ľṹ��ʽ��֪��F�ķ���ʽ��C10H10O4 �� �÷��ӵ���Է�������Ϊ194������������ʺɱ�Ϊ194�����Դ��ǣ�C10H10O4��194����4����������a����F��Ϊͬ���칹��b��������c�����ڶ�Ԫ����d��������ֻ��һ��ȡ���������F�Ľṹ��ʽ��֪�����������������л����ͬ���칹��Ϊ  ����3�֣� ���Դ��ǣ�3��
����3�֣� ���Դ��ǣ�3�� 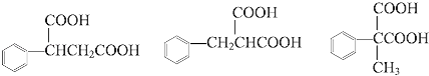 �е�����һ�֣���5��G����NaOH��Һ����ʱ��Ӧ�Ļ�ѧ����ʽΪ
�е�����һ�֣���5��G����NaOH��Һ����ʱ��Ӧ�Ļ�ѧ����ʽΪ 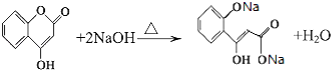 ��
��
���Դ��ǣ�  ����6����D�����Ȼ��ͷ��ǻ����Ȼ�����NaHCO3��Һ��Ӧ�������ǻ�������NaHCO3��Һ��Ӧ������1molD����1molNaHCO3��Һ��Ӧ���ʢٴ���EΪ
����6����D�����Ȼ��ͷ��ǻ����Ȼ�����NaHCO3��Һ��Ӧ�������ǻ�������NaHCO3��Һ��Ӧ������1molD����1molNaHCO3��Һ��Ӧ���ʢٴ���EΪ 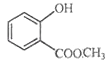 ���з��ǻ�������E����FeCl3��Һ������ɫ��Ӧ���ʢ���ȷ����BΪ���ᣬ��3�ֵ�Ч�⣬�������ֻ��2���⣬�����ܸ��ݺ˴Ź����������������ǣ��ʢ۴��ܸ���G�Ľṹ��ʽ��֪��G��������һ��������һ��̼̼˫��������1molG�������4molH2�����ӳɷ�Ӧ���ʢܴ���ѡ�ڣ�
���з��ǻ�������E����FeCl3��Һ������ɫ��Ӧ���ʢ���ȷ����BΪ���ᣬ��3�ֵ�Ч�⣬�������ֻ��2���⣬�����ܸ��ݺ˴Ź����������������ǣ��ʢ۴��ܸ���G�Ľṹ��ʽ��֪��G��������һ��������һ��̼̼˫��������1molG�������4molH2�����ӳɷ�Ӧ���ʢܴ���ѡ�ڣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѣ����ǡ��ڵ��ۡ��۵����ʡ�����֬��ϡ����ڵ������·ֱ����ˮ�⣬���ֻ�õ�һ�ֲ�����ǣ� ��
A. �ٺ͢� B. �� C. �ڢۺ͢� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϲ��ϵ��ŵ���(����)
��ǿ�ȸߡ��������ᡡ�����¡�����ʴ
A.���٢�
B.���ڢ�
C.������
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Al��NaOH��Һ��Ӧ��˵���У���ȷ����(����)
A.���ǻ�ԭ����������������NaAlO2
B.NaOH�����������仹ԭ������H2
C.Al�ǻ�ԭ����H2O��NaOH����������
D.ˮ����������������ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ���K2SO4Al2��SO4��32Al2O36H2O��������������������������ʯ�Ʊ�K2SO4�Ĺ���������ͼ��ʾ��
�ݴ�����ͼ�ش��������⣺
��1���ٱ���¯��Al2��SO4��3��S��Ӧ�IJ���������������÷�Ӧ�Ļ�ѧ����ʽΪ��д��¯����һ����;����
��2������Al2O3���뷴Ӧ�����ӷ���ʽΪ ��
��3�������pH������CO2��������
��4����ҵұ����������Ҫ���ڸ�����������̼���ԭ����
��5�������������������������Ӧ���ͣ����Ƶ�������Al��NiO��OH��Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱNiO��OH��ת��ΪNi��OH��2 �� �õ�ظ����ĵ缫��Ӧʽ�� ��
��6����������ʯ1625t�������������Ƶ�780tAl��OH��3 �� ������Ԫ�ص���ʧ�����������ʯ�м�Ԫ�ص���������Ϊ%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M������6������ |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | Ԫ�����������+7�� |
W | �䵥�ʼ��ܸ��ᷴӦ�����ܸ��Ӧ��������H2 |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�������������ͬλ�صķ����� ��
��2��Ԫ��Y����Ԫ���γ�һ������YH4+ �� д�������Ļ�ѧʽ������Ԫ�ط��ű�ʾ����
��3��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� �� �ٳ�����Z�ĵ��ʺ�T�ĵ���״̬��ͬ
��Z���⻯���T���⻯���ȶ�
��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
��4��̽Ѱ���ʵ����ʲ�������ѧϰ����Ҫ����֮һ��T��X��Y��Z����Ԫ�ص�����������Ӧ��ˮ�����л�ѧ�������Բ�ͬ���������ֵ������ѧʽ���������� �� Z������������Ӧ��ˮ������W������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ṥҵ��������Ҫ�ɷ�ΪSiO2��MgO��Al2O3��Fe2O3�ȡ����շ����н���Ԫ�صĹ����������£�
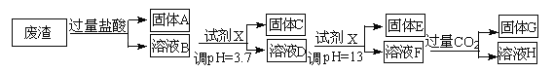
��֪���������£�
��������������������ʽ��ʼ������ǡ����ȫ����(������Ũ�ȵ���10-5mol��L-1 )ʱ��pH ���±���
ʾ��
������ | Fe3+ | Al3+ | Mg2+ |
��ʼ����ʱ��pH | 1.9 | 3.7 | 9.6 |
ǡ����ȫ����ʱ��pH | 3.2 | 5.2 | 11.0 |
�ڱ��Ͱ�ˮ��Һ��c(OH-)ԼΪ1��10-3mol��L-1��
��ش��������⣺
��1������CΪ_________(�ѧʽ)��
��2����������������ʹ���Լ�X���Լ�X��_________(������ˮ����������������)����������_________________��
��3����ҺD������E�Ĺ�������Ҫ������ҺpH=13�����pH��С�����ܵ��µĺ����________________��
��4��д����ҺF����ҺH �����ӷ���ʽ��__________________��
��5��Ksp[Mg (OH )2]=_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֺ����ᣬ�����ᣨH2SO3�������ᣨH2SO4���������ᣨH2SO4SO3����������ᣨH2S2O3���ȵȣ��ڹ�ҵ���й㷺��Ӧ�ã����Ƕ�Ӧ������ͬ��Ҳ����Ҫ�Ļ�����Ʒ��
��1����һ������������ƣ�Na2S2O3�������������Լ�������Ļ�ԭ���������ȡ������ֽ⣮��ҵ�ϳ����ú����ˮ����Na2S2O35H2O��ʵ���ҿ�������װ�ã���ȥ���ּӳ�������ģ�����ɹ��̣�
��ƿC�з�����Ӧ���£�
Na2S��aq��+H2O��l��+SO2��g��=Na2SO3��aq��+H2S��aq�� ����
2H2S��aq��+SO2��g��=3S��s��+2H2O��l�� ����
S��s��+Na2SO3��aq�� ![]() Na2S2O3��aq�� ����
Na2S2O3��aq�� ����
����ƿA�з�����Ӧ�����ӷ���ʽΪ�� �� װ��D�������� ��
��װ��B������֮һ�ǹ۲�SO2���������ʣ����е�Һ�����ѡ�� ��
a������ˮ b������Na2SO3��Һc������NaHSO3��Һ d������NaHCO3��Һ
�۷�Ӧ���ڿ��þƾ����ʵ�������ƿA��ʵ�����þƾ��Ƽ���ʱ����ʹ��ʯ�������������� ��
a���ձ� b�������� c���Թ� d����ƿ
��Ϊ�˱�֤��������ƵIJ�����ʵ����ͨ��SO2���ܹ�����ԭ���� ��
��2�����������������ƣ�Na2S2O5���dz��õ�ʳƷ��������֮һ��Na2S2O5����ˮ������NaHSO3 �� ��֤��NaHSO3��Һ��HSO3���ĵ���̶ȴ���ˮ��̶ȣ��ɲ��õ�ʵ�鷽����������ţ���
a���ⶨ��Һ��pH b������Ba��OH��2��Һc����������d������Ʒ����Һ e������ɫʯ����ֽ���
�����ѾƳ���Na2S2O5�������������ⶨij���Ѿ��п��������IJ�������������SO2���㣩�ķ������£�
���Ѿ���Ʒ100.00mL ![]() ���
��� ![]() ��Һ������ɫ��30s�ڲ���ɫ
��Һ������ɫ��30s�ڲ���ɫ
����ʽΪSO2+I2+2H2O=H2SO4+2HI������������ʵ�飬���ı�I2��Һ25.00mL���ô�ʵ������Ʒ�п��������IJ�������������SO2���㣩ΪgL��1 �� ����ʵ������У����в���HI���������������ý�����ƫ�ߡ���ƫ�͡����䡱������ԭ�������û�ѧ����ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̼���º���{[Ni��CHZ��3]��ClO4��2 }��һ�����͵���ҩ��
��1��Ni2+��̬��������Ų�ʽΪ ��
��2��ClO4���Ŀռ乹��������ClO4����Ϊ�ȵ������һ�ַ���Ϊ���ѧʽ����
��3����ѧʽ��CHZΪ̼���£����ΪCO��N2H3��2 �� ̼������̼ԭ�ӵ��ӻ��������Ϊ��1molCO��N2H3��2�����к��ЦҼ���ĿΪ ��
��4����������̼���º�������NiO�������ἰ̼���»��϶��ɣ�NiO�ľ����ṹ��ͼ��ʾ�������к��е�Ni2+��ĿΪa��Ni2+����λ��Ϊb��NiO������ÿ�������Ӿ����������������ĿΪc����a��b��c= �� 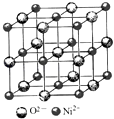
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com