
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。
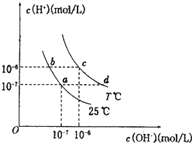
下列条件关于离子共存说法中正确的是
A. d点对应的溶液中大量存在:Na+、K+、S2-、SO32-
B. b点对应的溶液中大量存在:NH4+、K+、I-、NO3-
C. c点对应的溶液中大量存在:Na+、Fe3+、SO42-、Cl-
D. a点对应的溶液中大量存在:Fe2+、Ca2+、ClO-、SO42-
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢-氯化钠加合物( 4Na2SO4·2H2O2·NaCl)又称固体双氧水,具有漂白、杀菌、消毒等作用,其性质较稳定,因此具有广泛的应用前景。化学实验室中制备硫酸钠—过氧化氢—氯化钠加合物的流程如下:

已知:过氧化氢在碱性条件下不稳定。
4Na2SO4·2H2O2·NaCl的相对分子质量为694.5。
回答下列问题:
(1)控温反应中,反应的温度控制在10℃左右,不能太高的原因是____________。
(2)可用减压过滤得到产品。减压过滤装置中的陶瓷材料仪器名称是____________。
(3)上述工艺流程中,步骤B的操作是________。
(4)硫酸钠一过氧化氢一氯化钠加合物(4Na2SO4·2H2O2·NaCl)固体比过碳酸钠(2Na2CO3·3H2O2)固体更稳定的原因是___________。
(5)准确称取8.000 g固体双氧水样品,配制成250.00mL溶液,量取25.00mL溶液于锥形瓶中,加适量稀硫酸酸化后,用0.04000mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液20.00mL。判断滴定终点时的现象________________;产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学——人类进步的关键,化学知识与人们的生活息息相关。下列有关物质用途的叙述中,错误的是( )
A.单质硅可用于制光导纤维B.硅酸钠溶液可用作木材防火剂
C.Cl2常用于自来水消毒D.Na2O2可用于呼吸面具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( ) 
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.化石燃料是可再生性能源,燃烧时将化学能转变为热能
C.如图I所示的装置能将化学能转变为电能
D.如图II所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极反应式和总反应方程式:
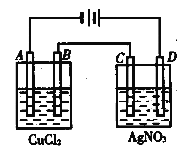
A:________________,B:__________________,总反应方程式:________________________;C:________________________________,D:________________________________,总反应方程式:___________________________;
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质所含分子数最多的是( )
A. 0.5 mol Cl2 B. 标准状况下3.36 L CO
C. 5.6g N2 (N2的摩尔质量为28 g·mol-1) D. 含NA个分子的O2(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO![]() :试液
:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 检验试液中的SO32-:试液![]() 气体
气体![]() 褐色
褐色
C. 检验试液中的I—:无色试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D. 检验试液中的CO![]() :试液
:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJmol﹣1、﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 . 请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是 kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)在直接以甲醇为燃料的电池中,理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能占燃料电池反应所能释放的全部能量的百分比).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com