
【题目】已知反应:2H2(g)+O2(g)![]() 2H2O(l) ΔH=571.6 kJ·mol1,下列对于反应2H2O(l)
2H2O(l) ΔH=571.6 kJ·mol1,下列对于反应2H2O(l)![]() 2H2(g)+O2(g)的说法不正确的是
2H2(g)+O2(g)的说法不正确的是
A.吸热反应 B.ΔS>0
C.只能在电解条件下进行 D.在一定温度下可以自发进行
科目:高中化学 来源: 题型:
【题目】化学电池在通讯,交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是__________。
2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是__________。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重。这是因为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-![]() Zn(OH)2、Ag2O+H2O+2e-
Zn(OH)2、Ag2O+H2O+2e-![]() 2Ag+2OH-。根据上述电极反应,判断下列叙述中正确的是
2Ag+2OH-。根据上述电极反应,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn电极发生还原反应,Ag2O电极发生氧化反应
D.Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的能源和化工原料,直接燃烧既浪费资源又污染环境。最近,某企业利用“煤粉加压气化制备合成气新技术”,让煤变成合成气(一氧化碳及氢气总含量≥90%),把煤“吃干榨尽”。下列有关说法正确的是( )
①煤粉加压气化制备合成气过程涉及化学变化和物理变化
②煤粉加压气化制备合成气过程涉及化学变化但没有物理变化
③该技术实现了煤的清洁利用
④该技术实现了煤的高效利用
A.①②③ B.①②④
C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一体积固定装有H2、CO、CO2混合气体的密闭容器,向其中加入过量的Na2O2,并不断用电火花点燃使其充分反应,反应结束后恢复至起始温度,测得容器内的压强(固体体积忽略不计)是起始状态的1/4。则原混合气体的平均相对分子质量可能是
A. 20g/mol B. 23g/mol C. 30g/mol D. 36g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题: 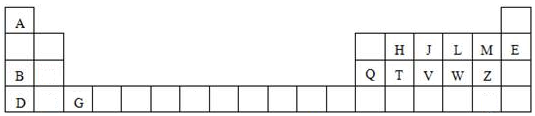
(1)原子半径最大的元素是;在化合物中只有负价的元素是;属于副族元素是;适合作半导体材料的是 , (只用表中的字母填写)
(2)V在周期表中的位置第周期第族.
(3)A与M元素形成的化合物是化合物,D与Z原子形成的化学键是键;
(4)J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是;(用化学式表示)
(5)L元素形成的氢化物的在﹣4℃时是晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是 .
(6)写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015江苏][双选]在体积均为1.0 L的两恒容密闭容器中加入足量的相同的炭粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+C(s)![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是一种日常生活中常见的金属,它既能与盐酸反应生成X3+和H2,又能与烧碱溶液反应生成XO2-和H2O.X的氢氧化物具有两性,但不与氨水反应;而Zn(OH)2与氨水反应生成[Zn(NH3)4]2+.试回答下列问题:
(1)X元素在元素周期表中的位置是______。
(2)X的氧化物也具有两性,写出其溶于烧碱溶液的离子方程式:_______。
(3)分离X3+与Zn2+的最佳方法是加入过量的____________。
(4)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,Z还可形成多种氢化物及其微粒,如Z2H4、Z2H5+、ZH4+等.
①写出Z2H4的电子式:________。
工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(Z2H4·H2O)、Na2CO3等产物,则该反应的化学方程式为_________。
查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜。取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在搞完下恰好完全反应生成氮气等产物,写出该反应的化学方程式:_______。
②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源开发利用的部分过程如图所示:

下列说法不正确的是
A. 海水淡化的常用方法有蒸馏法、 电渗析法和离子交换法
B. 可通过分液的方法分离溴单质和苯的混合物
C. 提纯时,所加试剂可依次为 BaCl2、 NaOH、 Na2CO3、盐酸
D. 精盐、 NH3和 CO2是侯德榜制碱工业的主要原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com