
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���Ա�������ĸ�����Ԫ�أ��ش��������⣺ 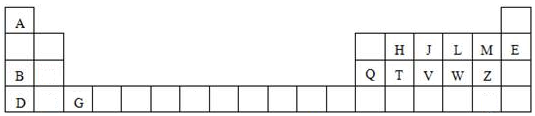
��1��ԭ�Ӱ뾶����Ԫ�������ڻ�������ֻ�и��۵�Ԫ���������ڸ���Ԫ�������ʺ����뵼����ϵ��� �� ��ֻ�ñ��е���ĸ��д��
��2��V�����ڱ��е�λ�õ����ڵ��壮
��3��A��MԪ���γɵĻ������������D��Zԭ���γɵĻ�ѧ��������
��4��J��H��T����Ԫ�ص���ۺ������������ǿ������˳���������û�ѧʽ��ʾ��
��5��LԪ���γɵ��⻯����ک�4��ʱ�����壨������ͣ������ܶȱȶ�Ӧ��Һ̬��С���ʹ�����������ԭ���� ��
��6��д��B��Q����Ԫ�ص��������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��D��M��G��T
��2������VA
��3�����ۣ�����
��4��HNO3��H2CO3��H2SiO3����H4SiO4��
��5�����ӣ�����֮�仹�ܲ������
��6��NaOH+Al��OH��3=NaAlO2+2H2O
���������⣺��1��ͼʾ���ڱ���D��G�ĵ��Ӳ���࣬����ԭ�Ӱ뾶�ϴ�����D�ĺ˵������С����ԭ�Ӱ뾶����ΪD��F��M���ķǽ�������ǿ�����ڻ�������ֻ�и��ۣ����ڱ���λ�ڽ�����ǽ������紦��Ԫ�ؿ����뵼����ϣ����ʺ����뵼����ϵ���T��Si�������Դ��ǣ�D��M��G��T����2������ͼʾ��֪��VΪPԪ�أ�λ�����ڱ��е�������VA�壬���Դ��ǣ�����VA����3��AΪH��MΪFԪ�أ�H��F�γɵĻ�����HFΪ���ۻ����D��Z�ֱ�ΪK��ClԪ�أ������γɵĻ�����ΪKCl���Ȼ���Ϊ���ӻ�������Դ��ǣ����ۣ����ӣ���4��J��H��T�ֱ�ΪN��C��SiԪ�أ��ǽ����ԣ�N��C��Si��������������Ӧˮ���������ǿ��Ϊ��HNO3��H2CO3��H2SiO3����H4SiO4�������Դ��ǣ�HNO3��H2CO3��H2SiO3����H4SiO4������5��LԪ��ΪO��O���⻯��Ϊˮ��ˮ�����γɵľ���Ϊ���Ӿ��壻���ڷ���֮�仹�ܲ������������ˮ�ڹ�̬ʱ���ܶȱȶ�Ӧ��Һ̬��С�����Դ��ǣ����ӣ�����֮�仹�ܲ����������6��B��Q�ֱ�ΪN��Al������Ԫ�ص��������Ӧ��ˮ����ֱ�ΪNaOH��Al��OH��3 �� ��������������������Ӧ�Ļ�ѧ����ʽΪ��NaOH+Al��OH��3=NaAlO2+2H2O�� ���Դ��ǣ�NaOH+Al��OH��3=NaAlO2+2H2O��


 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ṥҵ�еĴ�������Ӧ��������ȷ���ǣ� ��
A.�����ȷ�ӦB.�ڳ�ѹ�½���
C.�ڷ���¯�н���D.ʹ������ý������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ���ʵ���Һ����Բ�ͬ�������±���pH������жϣ�����˵���в���ȷ���ǣ� ��
���� | CuSO4��Һ | NaCl��Һ | ˮ | Na2CO3��Һ | NaOH��Һ | |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
A.����Һһ��������
B.�Լ��Ե���Һ��һ���Ǽ���Һ
C.����Һһ��������
D.����Һ��һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ���������жϣ�����ȷ����
A.���ԣ�H3PO4��H2SO4B.�ȶ��ԣ�HF��HCl
C.ԭ�Ӱ뾶��Na��SD.ʧ����������Ca��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2H2(g)+O2(g)![]() 2H2O(l) ��H=571.6 kJ��mol1�����ж��ڷ�Ӧ2H2O(l)
2H2O(l) ��H=571.6 kJ��mol1�����ж��ڷ�Ӧ2H2O(l)![]() 2H2(g)+O2(g)��˵������ȷ����
2H2(g)+O2(g)��˵������ȷ����
A�����ȷ�Ӧ B����S>0
C��ֻ���ڵ�������½��� D����һ���¶��¿����Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����һ�������Է����е���
A��2KClO3(s)![]() 2KCl (s)+3O2 (g) ��H= 78. 03 kJ�� mol1 ��S=+1 110 J/(mol��K)
2KCl (s)+3O2 (g) ��H= 78. 03 kJ�� mol1 ��S=+1 110 J/(mol��K)
B��CO(g)![]() C(ʯī��s)+
C(ʯī��s)+![]() O2(g) ��H=+ 110. 5 kJ�� mol1 ��S=89.36 J/(mol��K)
O2(g) ��H=+ 110. 5 kJ�� mol1 ��S=89.36 J/(mol��K)
C��4Fe(OH)2(s)+2H2O(l)+O2(g)![]() 4Fe(OH)3(s) ��H=444.3 kJ��mol1 ��S=280.1 J/(mol��K)
4Fe(OH)3(s) ��H=444.3 kJ��mol1 ��S=280.1 J/(mol��K)
D��NH4HCO3(s)+ CH3COOH(aq) ![]() CO2(g)+ CH3COONH4 (aq)+H2O(l) ��H=+37.3 kJ��mol1 ��S=+184.0 J/(mol��K)
CO2(g)+ CH3COONH4 (aq)+H2O(l) ��H=+37.3 kJ��mol1 ��S=+184.0 J/(mol��K)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��11��30����12��11�գ���������쵼���ڰ��蹲ͬ�������Ӧ������仯������������ɫˮƽ��ʵ������ɳ�����չ��Ҫ������������ɫˮƽ������������ϣ��������Դ��(����)
����Ȼ������ú����ʯ�͡���ˮ�ܡ���̫���ܡ������ܡ��߷��ܡ�������
A. �٢ڢۢ� B. �ݢޢߢ� C. �ۢܢݢ� D. ���٢���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ��صĵ⻯���������Ϳ�ѧʵ������ʮ����Ҫ��Ӧ�á���ҵ�����õ⡢�ռ����мΪԭ�Ͽ������⻯�ƣ�������������ͼ��ʾ��

��1��NaOH��Һ�͵ⷴӦʱ��Ҫ�ϸ�����¶ȣ�����¶ȹ��ͣ������ɵ�ĵͼ۸���ƷNaIO����NaOH��Һ�͵ⷴӦʱ������Һ��IO3-��IO-�����ʵ���֮��Ϊ1��1����÷�Ӧ�����ӷ���ʽΪ________________________________��
��2�����������м��������м��Ŀ����___________________���������ù����г�ʣ����м�⣬���к��ɫ���壬�������мʱ������Ӧ�Ļ�ѧ����ʽ��_________��
��3����Һ2�г�����H+�⣬һ�����е���������__________________�������ʵ��֤ʵ�ý��������ӵĴ��ڣ�____________________________��
��4����Һ2��һϵ��ת�����Եõ�������������(FeC2O4��2H2O)����ȡ3��60g�����������������ط���������ȷֽ⣬�õ�ʣ�������������¶ȱ仯��������ͼ��ʾ��

�ٷ���ͼ�����ݣ�д������I������Ӧ�Ļ�ѧ����ʽ��__________________________��
��300��ʱʣ�����������һ�������ͨ������ȷ����������Ļ�ѧʽ�� ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ԭ��ʱ����ԭ����ǿ����( )��
A. Al B. Fe C. Cu D. Na
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com