
【题目】下列试剂常用来检验Fe3+的是
A.氯水B.BaCl2溶液C.KSCN溶液D.KNO3溶液
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
I.CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2=+41.2kJ/mol
CO(g)+H2O(g) △H2=+41.2kJ/mol
III.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
CH3OH(g)+H2O(g)△H3=-49.53kJ/mol
某些物质的标准生成热 | ||||
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热。化学反应热:ΔH=生成物标准生成热总和一反应物标准生成热总和。计算 △H1=_____kJ/mol。
(2)在一容积可变的密团容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1,CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
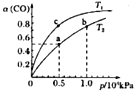
①a、b两点的反应速率:v(a)___v(b)(填“>”、“<”或“=”)
②T1____T2(填“>”、“<"或“=”),原因是___________________________。
③在c点条件下,下列叙述能说明上述反应达到化学平衡状态的是_____(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数Kp____(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
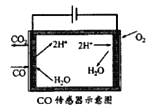
(3)合成甲醇尾气中CO的浓度常用电化学气敏传感器进行测量,其中CO传感器可用下图简单表示,则阳极发生的电极反应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法正确的是( )
CH3OH(g)达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应吸热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
B.从海水中提取物质都必须通过化学反应才能实现
C.中国首艘航母“辽宁舰”上用于舰载机降落拦阻索的特种钢缆是一种新型无机非金属材料
D.植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
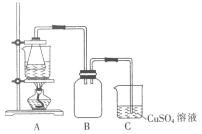
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(2)装置C的作用是__________________________。
(3)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(4)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________;产品的纯度为_________________(列出计算表达式即可)
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
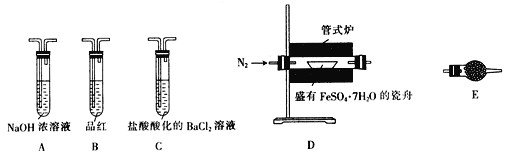
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (5)产物中含有___________。 |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (6)C中反应的化学方程式为________________________。 |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (7)_________________。 | (8)溶液中中含有__________。 |
(9)依据实验现象及产物,写出FeSO4·7H2O分解的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com