
【题目】下列说法正确的是( )
A.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
B.从海水中提取物质都必须通过化学反应才能实现
C.中国首艘航母“辽宁舰”上用于舰载机降落拦阻索的特种钢缆是一种新型无机非金属材料
D.植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)①向明矾溶液中逐滴滴入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的pH________7(填>或<或=),离子反应总方程式为______________;
②向明矾溶液中逐滴加氢氧化钡溶液至铝离子刚好沉淀完全时,溶液的pH________7(填>或<或=),离子反应总方程式为______________。
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为_____________________________________。
Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积V2 mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)____→____→____→ D →____
(2)使用滴定管之前应进行的操作是__________________。
(3)恰好达到滴定终点时的实验现象为_________________________________________。
(4)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响__________(填“偏高”、“偏低”或“无影响”)。
(5)该烧碱样品的纯度计算式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(位于第4周期ⅣA族)和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是( )
A.锗不能与强碱反应B.氢氧化锗具有两性
C.氧化锗易溶于水D.氧化锗的化学式为Ge2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

已知:①![]() ;②
;② 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
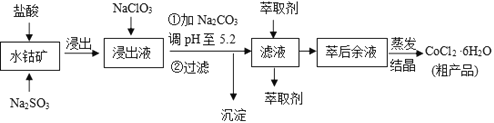
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________________________。
(2)写出NaClO3发生反应的主要离子方程式________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________________________________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________、_______________________
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________________。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______。(答一条即可)
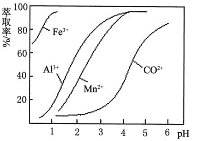
(6)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________;其使用的适宜pH范围是__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,研究小组用如图装置模拟该过程,并通过测定反应后溶液中SO32-的浓度来计算该反应的转化率。

实验步骤
①按图连接好装置,检查气密性;
②取200mL0.5000mol/L的(NH4)2SO3溶液(含有一定量氨水,pH=8)装入三颈烧瓶中,加入催化剂,控制气体流速为300L/h,控制温度在50℃进行实验;
③反应2.5小时后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器a的名称是____________________________________________。
(2)装置B的作用是_______________________________________________________。
(3)C中(NH4)2SO3被氧化,该反应的离子方程式为______________________;装置C中的反应需要控制溫度在50℃,采用的实验措施是______________________;C中溶液的pH不能低于8,原因是____________________________________________。
(4)取20.00mL反应后的溶液于碘量瓶中,滴入3滴淀粉溶液,用0.1000mol/L的标准碘溶液滴定至终点,消耗碘水体积为18.50mL,则(NH4)2SO3的转化率为_____________________。
(5)指出实验装置存在的缺陷_________________________________(写一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,2min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃,上述反应要看到同样的浑浊,需要的时间是
A. 48s B. 40s C. 20s D. 15s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com