
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
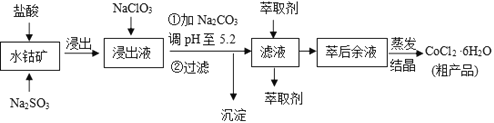
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________________________。
(2)写出NaClO3发生反应的主要离子方程式________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________________________________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________、_______________________
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________________。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______。(答一条即可)
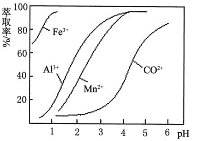
(6)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________;其使用的适宜pH范围是__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
【答案】Co2O3+SO32-+4H+=2Co2++SO42-+2H2O ClO3-+ 6Fe2++ 6H+=Cl-+ 6Fe3++ 3H2O ClO3-+5Cl-+6H+=3Cl2↑+3H2O Fe(OH)3 Al(OH)3 降低烘干温度,防止产品分解(或者失水) 粗产品含有可溶性氯化物或晶体失去了部分结晶水 除去溶液中的Mn2+ B
【解析】
(1)根据流程图结合信息浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等进行解答;
(2)NaClO3中氯元素化合价为+6价,为氧化剂,FeCl2中铁元素化合价+2价为还原剂;ClO3-和Cl-发生氧化还原反应生成Cl2;
(3)根据加Na2CO3调pH至5.2,5.2小于7.6,即此时溶液pH小于Co2+开始沉淀的pH解答;
(4)减压烘干目的是降低烘干温度,防止产品分解;
(5)根据CoCl2·6H2O的组成分析,可能是含有杂质,也可能是失去部分水;
(6)萃取剂的作用是除去溶液中的Mn2+,通过萃取率与pH的关系可以看出,pH达到3.0~3.5 是适宜pH范围。
(1)向水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原反应,根据电荷守恒和得失电子守恒,反应为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)加入NaClO3,会发生FeCl2中铁元素的化合价+2→+3,失去电子,NaClO3中氯元素的化合价由+5→-1价,得到电子,所以NaClO3发生反应的主要离子方程式为ClO3-+ 6Fe2++ 6H+=Cl-+ 6Fe3++ 3H2O,若NaClO3过量,ClO3-和Cl-发生氧化还原反应生成有Cl2,离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,
故答案为:ClO3-+ 6Fe2++ 6H+=Cl-+ 6Fe3++ 3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)加Na2CO3调pH至5.2,5.2小于7.6,即此时溶液pH小于Co2+开始沉淀的pH,因此可以防止Co2+被沉淀,此时只有Fe3+和Al3+沉淀下来,故过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3。
故答案为:Fe(OH)3、Al(OH)3;
(4)根据信息,减压烘干目的是降低烘干温度,防止产品分解,
故答案为:降低烘干温度,防止产品分解(或者失水);
(5)根据CoCl2·6H2O的组成分析,加入足量AgNO3溶液得到的是AgCl沉淀,而粗产品可能含有可溶性氯化物,使Cl-含量变大,或晶体本身失去了部分结晶水,都会造成质量分数大于100%,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水;
(6)滤液中含有Co2+、Mn2+,通过萃取率与pH的关系可以看出,当pH达到3~4时,Mn2+萃取基本完成,而Co2+几乎没有变化,因此,向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是:3.0~3.5,故本题正确答案为B。
故答案为:除去溶液中的Mn2+;B。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源,放电时Zn转化为ZnO。则该电池放电时下列说法正确的是()

A.将电能转化为化学能
B.氧气在石墨电极上发生氧化反应
C.电子由Zn电极经导线流向石墨电极
D.该电池放电时OH-向石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素 A、B、C、D、E 的最高价氧化物对应的水化物分别为 X、Y、M、Z、W,B 是短周期主族元素中原子半径最大的元素,常温下 X、Y、Z、W 均可与 M 反应,A、B、D、E 的原子序数及其对应 0.1mol/L X、Y、Z 、W 溶液的 pH 如图所示。
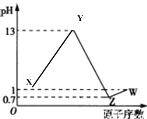
下列说法正确的是:
A. D的简单气态氢化物的热稳定性大于E的气态氢化物热稳定性
B. A、B、C 三种元素简单离子半径的大小顺序为C>B>A
C. Y 的稀溶液与 Z 或 W 的稀溶液分别发生中和反应时,对应的中和热在数值上相等
D. Y与W 两物质的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
B.从海水中提取物质都必须通过化学反应才能实现
C.中国首艘航母“辽宁舰”上用于舰载机降落拦阻索的特种钢缆是一种新型无机非金属材料
D.植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述不正确的是( )
A.天然油脂是混合物,没有固定的熔点和沸点
B.油脂是酯的一种
C.油脂是由高级脂肪酸和甘油所生成的酯
D.油脂都不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应HCl作还原剂的是
A.CaCO3+2HCl=CaCl2+CO2↑+H2O
B.NaOH+HCl=NaCl+H2O
C.Zn+2HCl=ZnCl2+H2↑
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com