
【题目】工业用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,研究小组用如图装置模拟该过程,并通过测定反应后溶液中SO32-的浓度来计算该反应的转化率。

实验步骤
①按图连接好装置,检查气密性;
②取200mL0.5000mol/L的(NH4)2SO3溶液(含有一定量氨水,pH=8)装入三颈烧瓶中,加入催化剂,控制气体流速为300L/h,控制温度在50℃进行实验;
③反应2.5小时后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器a的名称是____________________________________________。
(2)装置B的作用是_______________________________________________________。
(3)C中(NH4)2SO3被氧化,该反应的离子方程式为______________________;装置C中的反应需要控制溫度在50℃,采用的实验措施是______________________;C中溶液的pH不能低于8,原因是____________________________________________。
(4)取20.00mL反应后的溶液于碘量瓶中,滴入3滴淀粉溶液,用0.1000mol/L的标准碘溶液滴定至终点,消耗碘水体积为18.50mL,则(NH4)2SO3的转化率为_____________________。
(5)指出实验装置存在的缺陷_________________________________(写一条)
【答案】锥形瓶 提供饱和水蒸气,避免气体带走C中水蒸气使溶液体积减小,导致转化率的计算不准确 2SO32-+O2=2SO42- 用水浴加热 防止生成SO2逸出 81.5% 没有吸收NH3的装置、没有温度计、没有加热装置(写一条即可)
【解析】
(1)由图可知仪器a的名称是锥形瓶;
(2)装置B的作用是提供饱和水蒸气,避免气体带走C中水蒸气使溶液体积减小,导致转化率的计算不准确;
(3)C中(NH4)2SO3被氧化成(NH4)2SO4;要使受热均匀,控制温度在50℃,采用的实验措施是用水浴加热;酸性强,易生成SO2。
(4)根据反应方程式SO32-+I2+H2O═SO42-+2I-+2H+计算;
(5)实验装置存在的缺陷:没有吸收NH3的装置、没有温度计、没有加热装置等。
(1)由图可知仪器a的名称是锥形瓶;
(2)装置B的作用是提供饱和水蒸气,避免气体带走C中水蒸气使溶液体积减小,导致转化率的计算不准确;
(3)C中(NH4)2SO3被氧化成(NH4)2SO4,该反应的离子方程式为2SO32-+O2=2SO42-;要使受热均匀,装置C中的反应需要控制温度在50℃,采用的实验措施是用水浴加热;酸性强,易生成SO2,C中溶液的pH不能低于8,原因是防止生成SO2逸出;
(4)根据反应方程式SO32-+I2+H2O═SO42-+2I-+2H+可知,n(SO32-)=n(I2)=0.1000mol/L×18.50×10-3L,则(NH4)2SO3的转化率为=1-![]() =0.815,即81.5%。
=0.815,即81.5%。
(5)根据实验原理可知,该实验装置存在的缺陷:没有吸收NH3的装置、没有温度计、没有加热装置(写一条即可)。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g),达到限度后,欲提高一氧化碳的转化率,可以采取的措施为( )
CO2(g)+H2(g),达到限度后,欲提高一氧化碳的转化率,可以采取的措施为( )
A. 使用催化剂 B. 增大压强
C. 增大一氧化碳的浓度 D. 增大水蒸气的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
B.从海水中提取物质都必须通过化学反应才能实现
C.中国首艘航母“辽宁舰”上用于舰载机降落拦阻索的特种钢缆是一种新型无机非金属材料
D.植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为___________。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q五种元素,它们的原子序数依次增大, 已知W与其余四种元素既不同周期也不同主族;X和Z的基态原子的核外电子均排布在3个能级上,且均有2个未成对电子;Q元素原子质子数为29。
(1)按电子排布,Q元素在周期表中属____________区。
(2)第一电离能Y______Z,电负性Y______Z(填“>”,“=”或“<”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2;W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为______,YW3分子的立体构型为_____,YW3极易溶于W2Z的主要原因有___________________。(写出两点即可)
(4)Q+基态核外电子排布式为________________________________。
(5)Q+与Y3-形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏加德罗常数用NA 表示,则晶体的密度为_____________g·cm-3。
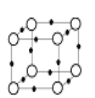
o-Y3- -Q+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
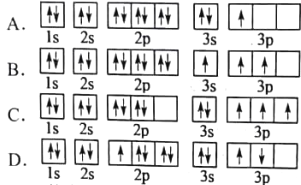
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
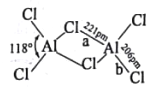
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com