
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
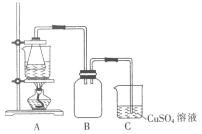
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________。
(2)装置C的作用是__________________________。
(3)步骤④中洗涤时所用的洗涤剂最好是______(填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(4)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________;产品的纯度为_________________(列出计算表达式即可)
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
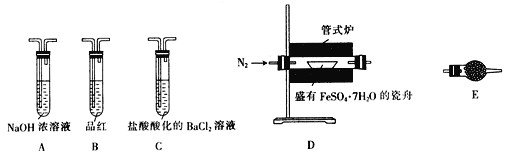
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (5)产物中含有___________。 |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (6)C中反应的化学方程式为________________________。 |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (7)_________________。 | (8)溶液中中含有__________。 |
(9)依据实验现象及产物,写出FeSO4·7H2O分解的化学方程式:_________________。
【答案】保证溶液中都是Fe2+ 除去H2S、PH3等杂质 B 除去蒸馏水中的氧气 ![]() 产物中有二氧化硫 SO3+H2O+BaCl2===BaSO4↓+2HCl 溶液变成血红色 溶液含有Fe3+ 2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
产物中有二氧化硫 SO3+H2O+BaCl2===BaSO4↓+2HCl 溶液变成血红色 溶液含有Fe3+ 2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
【解析】
I.(1)步骤②中需控制硫酸的用量,使铁粉过量,保证溶液中不含Fe3+;
(2) 铁屑中含有少量FeS、Fe3P等,与稀硫酸反应产生H2S、PH3等污染性气体;
(3) A.稀硝酸能氧化亚铁离子;B.无水乙醇能同时带走FeSO4·7H2O表面的水;
C.苯与水不溶,不适合作洗涤剂;
(4) 配制硫酸亚铁溶液所用的蒸馏水应预先煮沸,以除去溶解在水中的氧气;滴定过程中KMnO4将Fe2+氧化为Fe3+,发生反应的离子方程式为MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O,根据反应关系求出产品纯度;
Ⅱ.(5)气体产物经过试管B时,分解得到的产物中含SO2,品红溶液褪色;
(6)气体产物经过试管C时,与氯化钡溶液反应生成白色沉淀;
(7)将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液,溶液变红;
(8)因为产物中含有SO2,S元素化合价降低则Fe元素化合价会升高,溶于足量稀硫酸后溶液含有Fe3+;
(9)依据实验现象知产物为Fe2O3、SO2、SO3和H2O,据此可写出FeSO4·7H2O分解的化学方程式。
I.(1)步骤②中需控制硫酸的用量,使铁粉过量,保证溶液中不含Fe3+;
故答案为:保证溶液中都是Fe2+;
(2) 铁屑中含有少量FeS、Fe3P等,与稀硫酸反应产生H2S、PH3等污染性气体,故装置C的作用是除去H2S、PH3等杂质;
故答案为:除去H2S、PH3等杂质;
(3) A.稀硝酸能氧化亚铁离子,选项A不选;
B.无水乙醇能同时带走FeSO4·7H2O表面的水,选项B选;
C.苯与水不溶,不适合作洗涤剂,选项C不选;
故答案为:B;
(4) 配制硫酸亚铁溶液所用的蒸馏水应预先煮沸,以除去溶解在水中的氧气;滴定过程中KMnO4将Fe2+氧化为Fe3+,发生反应的离子方程式为MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O,根据反应关系,产品纯度为![]() ;
;
故答案为:除去蒸馏水中的氧气;![]() ;
;
Ⅱ.(5)气体产物经过试管B时,分解得到的产物中含SO2,品红溶液褪色;
故答案为:产物中有二氧化硫;
(6)气体产物经过试管C时,与氯化钡溶液反应生成白色沉淀,C中反应的化学方程式为SO3+H2O+BaCl2===BaSO4↓+2HCl;
故答案为:SO3+H2O+BaCl2===BaSO4↓+2HCl;
(7)将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液,溶液变红;
故答案为:溶液变成血红色;
(8)因为产物中含有SO2,S元素化合价降低则Fe元素化合价会升高,溶于足量稀硫酸后溶液含有Fe3+;
故答案为:溶液含有Fe3+;
(9)依据实验现象及产物,FeSO4·7H2O分解的化学方程式:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O。
故答案为:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O。


科目:高中化学 来源: 题型:
【题目】在蔬菜的生长过程中,常喷洒农药防治病虫害。据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上的农药毒性降低。因此买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间。浸泡蔬菜时可加入下列物质中的( )
A.纯碱B.白酒
C.白糖D.食醋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D. 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

已知:①![]() ;②
;② 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,错误的是
A.酸性:H2SO4>H3PO4
B.沸点:H2S>H2O
C.热稳定性:Na2CO3>NaHCO3
D.碱性:NaOH>Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com