
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
【答案】 )2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=2(E1-E2)kJ·mol 1 ![]() < C d 乙池 甲池 H2S+
< C d 乙池 甲池 H2S+![]() =3I-+S↓+2H+
=3I-+S↓+2H+
【解析】分析:本题是对化学反应原理的综合考察。根据盖斯定律进行反应热的计算,正反应活化能与逆反应活化能的差值为反应热;利用反应达到平衡时v正=v逆进行反应平衡常数的计算;根据图示可知,氧气变为过氧化氢,发生还原反应,该极为电解池的阴极,硫化氢变为单质硫,发生氧化反应,该极为电解池的阳极,发生氧化反应,氢离子向阴极移动,据此解答此题。
详解:(1)正反应活化能为E3-E2 ,逆反应活化能为E3- E1;生成1 mol水蒸气,该反应的反应热为ΔH=(E3-E2)-(E3- E1)=(E1-E2)kJ·mol 1,所以该反应的热化学方程式:H2(g)+NO(g)=1/2N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol 1或为2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=2(E1-E2)kJ·mol 1;正确答案:2H2(g)+2NO(g)=N2(g)+2H2O(g)ΔH=2(E1-E2)kJ·mol 1。
(2)①I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
由反应达平衡状态,所以v1正= v1逆、v2正= v2逆,所以v1正×v2正= v1逆×v2逆,即
即k1正.c2(NO)×k2正.c(N2O2)c(O2)= k1逆.c(N2O2)× k2逆.c2(NO2),则有:K= c2(NO2)/ c2(NO)×c(O2)=![]() ;正确答案:
;正确答案:![]() 。
。
②因为决定2NO(g)+O2(g)2NO2(g)速率的是反应II,所以反应I的活化能E1远小于反应II的活化能E2;决定反应速率的是反应II,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;正确答案:< ;C。
③v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为d ;正确答案:d。
(3) ①从示意图中看出,电子流向碳棒一极,该极为正极,氢离子从乙池移向甲池;正确答案:乙池 ;甲池。
②乙池溶液中,硫化氢与I3-发生氧化还原反应:硫化氢失电子变为硫单质,I3-得电子变为I-,离子反应为H2S+I3-=3I-+S↓+2H+;正确答案:H2S+I3-=3I-+S↓+2H+。


科目:高中化学 来源: 题型:
【题目】用图所示装置电解硫酸铜和氯化钠的混合溶液,当线路中有1.20mol电子通过时,甲电极增重并有4.48L(已折算成标准状况下的体积,后同)气体生成,乙电极同时生成气体7.84L,则原溶液中硫酸铜与氯化钠的物质的量之比为
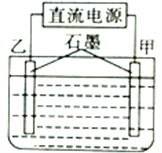
A. 2:1 B. 4:1 C. 2:3 D. 4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
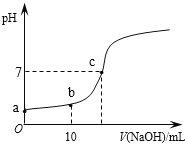
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯(柠檬烯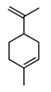 )。提取柠檬烯的实验操作步骤如下:
)。提取柠檬烯的实验操作步骤如下:
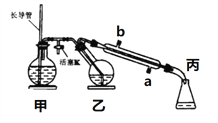
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水
(2)松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A. 当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B. 蒸馏结束后,为防止倒吸,立即停止加热
C. 长玻管作安全管,平衡气压,防止由于导管堵塞引起爆炸
D. 要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;
②2SO2+SeO2+2H2O===Se+2SO42—+4H+。
(1) Se与浓H2SO4的反应中,氧化剂是________________,还原剂是_______________。当有标准状况下22.4 L SO2气体生成时,转移电子的物质的量是________ mol。
(2)依据反应①、②判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是______________________。
(3)用单线桥法标出反应②电子转移的方向和数目:_____________________________。
(4)SeO2、KI和HNO3发生如下反应:SeO2+KI+HNO3―→Se+I2+KNO3+H2O配平上述反应的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种重要的有机合成中间体,由化合物A合成H的一种路线如下:
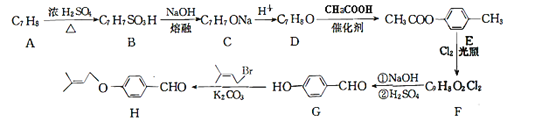
已知:RCHCl2 ![]() RCHO回答下列问题:
RCHO回答下列问题:
(1)A的化学名称为___________。
(2)G生成H的反应类型为__________,F中官能团名称是_____________。
(3)由A生成B的化学方程式____________________________,合成过程中D生成E的作用是_____________________。
(4)满足下列条件的H的同分异构体有________种,写出其中核磁共振氢谱有4组峰,且峰面积比为6:2:2:1:1:1:1的结构简式___________。
①能够发生银镜反应,能够发生水解反应,水解后的产物能与FeCl3溶液发生显色反应
②分子中只有一个环 ③苯环上有两个取代基,分子中含有两个甲基。
(5) 己知![]() ,参照上述合成路线,以
,参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的路线__________。
的路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol/L的一元碱BOH与等浓度盐酸等体积混合后,所得溶液中部分微粒组分及浓度如图所示。下列说法正确的是( )
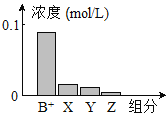
A.BOH为强碱
B.该混合液pH=7
C.该混合溶液中:c(B+)+c(Y)=c(Cl-)
D.图中X表示BOH,Y表示H+,Z表示OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是
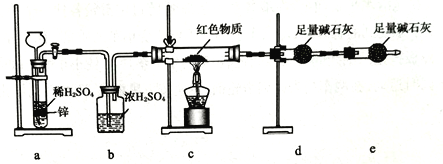
A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com