
【题目】常温下,0.2 mol/L的一元碱BOH与等浓度盐酸等体积混合后,所得溶液中部分微粒组分及浓度如图所示。下列说法正确的是( )
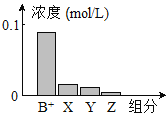
A.BOH为强碱
B.该混合液pH=7
C.该混合溶液中:c(B+)+c(Y)=c(Cl-)
D.图中X表示BOH,Y表示H+,Z表示OH-
【答案】C
【解析】
试题分析:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2OHA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA)。A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2OHA+OH-,NaA水解,HA为弱酸,故A错误;B.c(Na+)>c(A-),说明NaA水解,A-+H2OHA+OH-,该混合液pH>7,故B错误C.X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒c(Na+)=c(A-)+c(HA),故C正确;D.由分析可知,X表示OH-,Y表示HA,Z表示H+,故D错误;故选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法正确的是( )
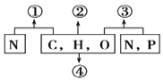
A. 若①为某种大分子的组成单位,则①可能是肽链
B. 若④是主要在动物肝脏和肌肉中合成的储能物质,则④一定是糖原
C. 若③为能储存遗传信息的大分子物质,则③一定是DNA
D. 若②是细胞中重要的储能物质,则②一定是脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM10、PM2.5、SO2、NO2、O3、CO等物质。研究脱硝(除NOx)技术和脱硫(除SO2)技术都是环境科学研究的热点,对于消除环境污染有重要意义。
(1)已知催化剂存在的条件下H2可以将NO还原为N2。下图是一定条件下H2还原NO生成N2和1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________________ 。(ΔH用E1、E2、E3表示)

(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)2NO2(g)的反应历程分两步:
I.2NO(g)N2O2(g)(快); v1正=k1正.c2(NO); v1逆=k1逆.c(N2O2) △H1<0
II.N2O2(g)+O2(g)2NO2(g)(慢); v2正=k2正.c(N2O2)c(O2); v2逆=k2逆.c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=__________________。
②决定2NO(g)+O2(g)2NO2(g)速率的是反应 II,反应 I的活化能E1与反应 II的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是___。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
③由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为____(填字母)。

(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

已知甲池中发生的反应为:
①装置中H+从__________ 移向__________(填“甲池”或“乙池”)。
②乙池溶液中发生的反应为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
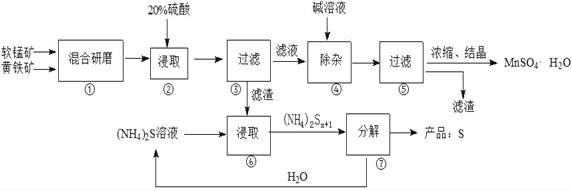
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A. 盐酸溶液的导电能力一定比醋酸溶液的强
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C. 向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D. 用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,最好选用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
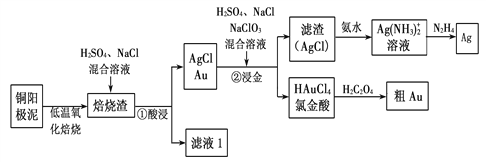
(1)氯金酸(HAuCl4)中的Au的化合价为________。
(2)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________。
(3)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________。
(4)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________。
(6)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合右图分析(其中的纵坐标代表金属阳离子浓度的对数):
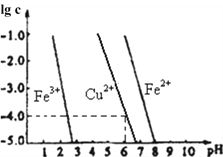
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________________________________,然后加入适量的CuO调节pH=3.7,除去________离子;
②从图中数据计算可得Cu(OH)2的Ksp约为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质均含有同一种元素,它们之间存在如图所示的转化关系:
![]()
(1)若A、B、C均属于盐类且为厨房中的常见物质,则B为_________,列举其在生活中的一种用途________。
(2)若A、C均属于盐类,且A常用作净水剂,B为白色胶状不溶物,A与过量氨水反应的离子方程式为_____________________________________。
(3)若A为一种无色气体单质,X为一种黑色固体单质,则C为_________,B与Na2O2反应方程式____________________________。
(4)若A为一种金属单质,X为一种无色气体单质,C为淡黄色粉末,将A投入CuSO4溶液中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O

(1)该蓄电池放电工作时电解质溶液中SO42-移向________(填“正极”或“负极”,下同)充电时,该极接直流电源的_________。
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________(不考虑气体的溶解及电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com