
【题目】物质的量的单位是()
A.千克B.千焦C.毫升D.摩尔
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
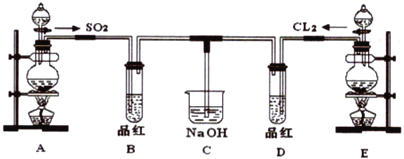
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________。
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①指出该反应中在反应中HCl(浓)所表现出的化学性质_____________、___________。
②请把(2)中的化学方程式改写为离子方程式_______________________________________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项,下同。
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为__________。
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是________________________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s)设计的原电池如图所示.
请回答下列问题:
(1)电解质溶液Y是;
(2)Cu电极发生的电极反应为X电极上发生的电极反应为;
(3)外电路中的电流是从电极流向电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),湿法炼铜工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为________________________________.
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为__________________________________________________
Ⅱ,配位浸出
反应原理为:CuFeS2+NH3·H2O+O2+OH-→ Cu(NH3)42++Fe2O3+SO42-+H2O(未配平)
(2)用化学用语解释氨水溶液的酸碱性______________________________.
(3)生产中为了稳定溶液的pH,可以在浸出液加入___________________(物质名称)Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
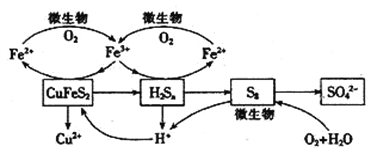
(4)在微生物的作用下,可以循环使用的物质有_________(填化学式),微生物参与的离子反应方程式为_______________________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O==2H++Cl-+ClO-
B. 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2
C. 酸性溶液中KBrO3与KBr反应生成Br2:BrO3-+Br-+6H+=Br2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+ Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:W是地壳中含量居第二位的元素,且X、Y、Z、W在元素周期表中的位置如图所示。下列说法正确的是
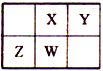
A. 最高正化合价:Z>X=W>Y B. 原子半径:Y>X>W>Z
C. 最高价氧化物对应水化物的酸性:Z<W<X<Y D. 最高价含氧酸的钠盐溶液能与CO2反应的元素:X、Y、Z、W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
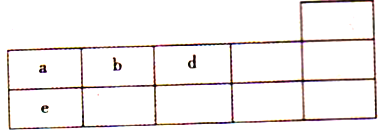
(1)a原子结构示意图为___________,d的一种氢化物为常见溶剂,其电子式为__________。
(2)e的最高价氧化物对应水化物的钠盐液中通入少量a的最高价氧化物会发生反应,写出相应的离子方程式:____________________________________。
(3)X、Y为同周期元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两种元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的化学方程式:____________________________,X在周期表中的位置为________________。
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的。工业上制取Y和W的无水化合物方法如下:Y的氧化物与a、W的单质在高温条件下反应,每消耗6kg a的单质,过程中转移1×103mol电子,写出相应反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的( )
A.钠与水的反应:2Na+2H2O═2Na++2OH﹣+H2↑
B.硅酸钠溶液中通入过量CO2:SiO ![]() +2CO2+2H2O═H2SiO3↓+2HCO3﹣
+2CO2+2H2O═H2SiO3↓+2HCO3﹣
C.氯气与水反应:Cl2+H2O═2H++Cl﹣+ClO﹣
D.明矾溶液中加入过量的Ba(OH)2溶液:Al3++4OH﹣═AlO2﹣+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com