
【题目】下列说法正确的是
A.氨水加水稀释后,溶液中c(NH3H2O)/c(NH4+)的值减小,c(H+)增大
B.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
C.一定温度下,增大反应2BaO2(s)![]() 2BaO(s)+O2(g)容器的体积,平衡不移动
2BaO(s)+O2(g)容器的体积,平衡不移动
D.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
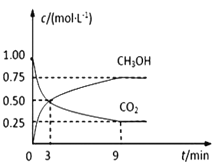
(1)从3 min到9 min,υ(H2)=________;
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 molL-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是
A.该溶液的pH=4
B.此溶液中,HA约有0.1%发生电离
C.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
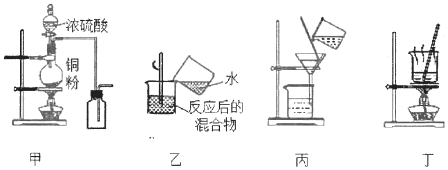
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型太阳光电化学电池贮能时电解质溶液中离子在两极发生如下图所示的转化。

下列说法正确的是( )
A. 贮能时,电能转变为化学能和光能
B. 贮能和放电时,电子在导线中流向相同
C. 贮能时,氢离子由a极区迁移至b极区
D. 放电时,b极发生:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用绿矾制备还原铁粉的工业流程如下:
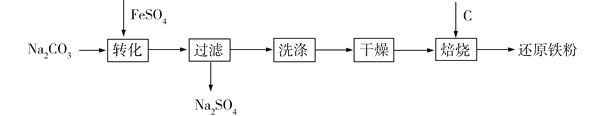
(1)制备FeCO3时,选用的加料方式是_______________(填字母)。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________。
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为________________。
(4)取干燥后的FeCO3样品12.49 g隔绝空气焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为_______________(写出一种即可),计算FeCO3样品中FeCO3与FeOOH的质量_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①保持温度、体积一定,能说明上述反应达到平衡状态的是____。
A.容器内压强不变 B.3v正(CH3OH)= v正(H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②测得不同温度时CH3OH的物质的量随时间的变化如图1所示,则ΔH____0(填“>”或“<”)。
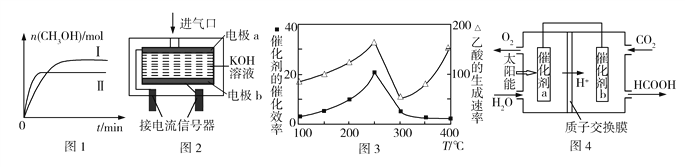
(2)工业生产中需对空气中的CO进行监测。
①PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为______。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为______。
(3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是______。
(4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(![]() )=____。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
)=____。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
(5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是____(填“a→b”或“b→a”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式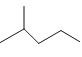 表示的分子式____________。
表示的分子式____________。
(2)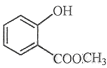 中含有的官能团的名称为____________________________。
中含有的官能团的名称为____________________________。
(3)丙基的2种结构简式____________________________。
(4)用系统命法写出下列物质名称
 ________________________________
________________________________
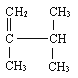 ________________________________
________________________________
![]() ________________________________________
________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___(填字母)
A.热裂解形成燃油 | B.露天焚烧 |
C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:__________。
(3)控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1
H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是_________________________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液,加热,生成
CuCl 的离子方程式是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com