
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
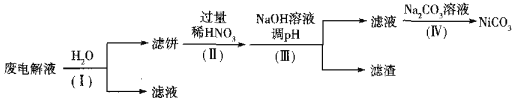
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
【答案】![]() +3 NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F 阳 H2 除去NH4HF2 3Ni+8H++2NO3-=3Ni2++2NO+4H2O 6.7≤pH<7.2
+3 NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F 阳 H2 除去NH4HF2 3Ni+8H++2NO3-=3Ni2++2NO+4H2O 6.7≤pH<7.2
【解析】
(1)NF3为共价化合物,电子式为![]() ,N为+3价、F为-1价,
,N为+3价、F为-1价,
故答案为:![]() ;+3;
;+3;
(2)F2与NH3直接反应生成NF3,同时生成HF或NH4F,方程式为NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F,
故答案为:NH3+3F2=NF3+6HF或4NH3+3F2=NF3+3NH4F;
(3)①利用电解熔融NH4HF2(NH4FHF)法制取NF3,N元素被氧化,应为阳极反应;阴极生成氢气,
故答案为:阳;H2;
②由流程可知,加水溶解,可除去NH4HF2,加入过量稀硝酸,金属溶解,Ni溶于硝酸的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO+4H2O,调节溶液pH,使铜离子、铁离子完全沉淀,且避免镍离子沉淀,则调节pH的范围为6.7≤pH<7.2,
故答案为:除去NH4HF2;3Ni+8H++2NO3-=3Ni2++2NO+4H2O;6.7≤pH<7.2。


科目:高中化学 来源: 题型:
【题目】下列有机化合物对应类别的同分异构体数目最少的是(不考虑立体异构)
选项 | A | B | C | D |
分子式 | C9H12 | C5H12O | C4H8O2 | C4H8FCl |
类别 | 芳香烃 | 醇 | 酯 | 卤代烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年发生的天津港有关仓库物品爆炸涉及电石与氰化钠等,而CN-作为配位剂可形成[Au(CN)2]-、[Ag(CN)2]-、[Zn(CN)4]2-、[Fe(CN)3]4-、[Fe(CN)4]3-等。常把原子个数相同,最外层电子数也相同的微粒称作等电子体,同时它们的结构相似。
试分析并回答:
(1)电石的主要成分是__________(写化学式),其中阴离子与CN-是等电子体,写出CN-的电子式:__________。
(2)有着“闪电式死亡”之称的剧毒物品氰化钠,在地面水中很不稳定,pH大于7时,可被氧气氧化成碳酸盐和氨气,试写出该反应的离子方程式:______。
(3)以剧毒物氰化钠比例,从反应原理角度去思考如何防止其污染。试提出两个有关应用的好方案________、_______。
(4)电石中还含有CaS等,与水反应还有H2S的生成,H2S完全氧化生成S2,S2又可催化氧化生成SO3。已知2SO2(g)+O2(g)![]() 2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
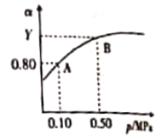
则①Y大于0.8的原因是__________;
②K(A)____________(填“大于”“等于”或“小于”)K(B);
③若压强为0.10MPa,试做出T1、T2不同温度下(设T2< T1)SO2转化率与温度的关系图__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如下图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是( )

A. 电子由M极经外电路流向N极
B. N电极区的电极反应式为2H++2e-=H2↑
C. 在碱液室可以生成 NaHCO3、Na2CO3
D. 放电一段时间后,酸液室溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2C2O4的电离常数:Ka1=5.4×10-2,Ka2=5.0×10-5。在V1mL0.1molL-1H2C2O4溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示。下列说法正确的是( )
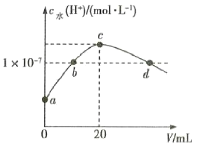
A.V1=20mL
B.b点和d点对应的溶液中都存在:c(K+)=c(HC2O4-)+2c(C2O42-)
C.常温下,加水稀释b点对应的溶液,稀释后溶液pH减小
D.常温下,KHC2O4的Kh1=2×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | ||||||||
1 | ① | ⅡA | …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ||||||||
(1)②元素简单氢化物的电子式是________________________。
(2)③、④、⑤、⑦元素的离子半径由大到小的顺序为______________。
(3)⑥元素的名称为_______________,举出⑥单质的一个应用____________。
(4)上述所有元素中最高价氧化物对应的水化物的酸性最强的是_____________, 写出一个能证明⑧比⑦非金属性强的一个离子反应方程式___________________。
(5)有两种化合物A和B都由①③④⑦四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为____________。
(6)⑨与④的原子序数之差为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述错误的是
A. 1mol月球表面的氦-3(![]() )含有质子为2NA
)含有质子为2NA
B. 1L![]() 的
的![]() 溶液中,含有0.1NA个
溶液中,含有0.1NA个![]()
C. 标准状况下,22.4L![]() 中所含分子数为NA
中所含分子数为NA
D. 标准状况下,1mol金刚石中含有的C-C键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
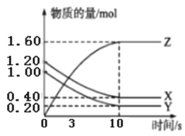
A.该反应的化学方程式为3X+Y![]() 2Z
2Z
B.3s时,正逆反应速率相等
C.平衡时X的浓度为0.40mol/L
D.10s时,该反应达到了最大限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com