
【题目】(1)工业上用洗净的废铜屑作原料来制备硫酸铜。下列制备方法符合“绿色化学”思想的是_________(填序号)。
①![]() ②
②![]()
写出①中反应的化学方程式:_____________________。
(2)SO2被称为“空中死神”,其对环境的危害常表现为__________________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于__________氧化物的性质。
(3)硫元素是一种常见的非金属元素,硫原子的原子结构示意图为_______,自然界中存在的某种单质以八个原子结合,其分子式为_______。
(4)氮元素是大气中含量最高的元素,其单质的电子式___________。由于该单质比较稳定,只能与部分活泼金属反应,比如在点燃条件下,可与金属镁反应,试写出该反应方程式___________________________。
【答案】 ② Cu + 2H2SO4(浓)![]() CuSO4 + SO2 ↑ + 2H2O 形成酸雨 酸性
CuSO4 + SO2 ↑ + 2H2O 形成酸雨 酸性 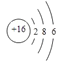 S8
S8 ![]() 3Mg+N2
3Mg+N2![]() Mg3N2
Mg3N2
【解析】(1)原子利用率达到100%符合绿色化学;铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)根据二氧化硫的性质以及对环境的危害分析解答;
(3)硫原子的质子数是16,据此书写结构示意图;根据硫原子的个数书写分子式;
(4)氮气分子中含有三键;氮气与镁反应生成氮化镁。
(1)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,有污染性气体二氧化硫生成,原子利用率不是100%,因此符合“绿色化学”思想的是反应②。铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)SO2被称为“空中死神”,其对环境的危害常表现为形成酸雨。二氧化硫是酸性氧化物,能与碱性氧化物氧化钙反应,因此工业上常用生石灰来处理煤炭中的SO2。
(3)硫原子的原子序数是16,原子结构示意图为 ;自然界中存在的某种单质以八个原子结合,其分子式为S8。
;自然界中存在的某种单质以八个原子结合,其分子式为S8。
(4)氮元素是大气中含量最高的元素,其单质的电子式为![]() 。在点燃条件下,氮气可与金属镁反应生成氮化镁,该反应的方程式为3Mg+N2
。在点燃条件下,氮气可与金属镁反应生成氮化镁,该反应的方程式为3Mg+N2![]() Mg3N2。
Mg3N2。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关遗传物质的叙述,正确的是
A. 豌豆的遗传物质主要是DNA B. 烟草花叶病毒的碱基5种,核苷酸有8种
C. 细菌细胞的遗传物质中含有S元素 D. 人细胞的遗传物质初步水解后能产生4种脱氧核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
I.提出假设:
(1)甲同学:可能只是MgCO3
乙同学:可能只是__________________
丙同学:可能是xMgCO3·yMg(OH)2
(2)在探究沉淀成分前,需将沉淀从溶液中过滤、洗涤、低温干燥,洗涤沉淀的操作方法是_________。
Ⅱ.定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持装置未画出),经实验前后对比各装置的质量变化来分析沉淀样品的组成,得出丙同学的假设是正确的。请回答下列问题:

(3)写出xMgCO3·yMg(OH)2受热分解的化学方程式_________________________(用x、y 表示)
(4)①实验中合理的实验装置连接顺序为;e→____→_____→____→_____→____→_____→____(各装置只使用一次)___________________
②实验一段时间后,当装置B中_____________(填实验现象)时,停止加热,说明沉淀样品已完全分解,然后打开f处的活塞,缓缓通入空气数分钟的目的是_____________________________________。
③指导老师认为在上述实验装置末端还需再连接一个装置D,若无此装置,则会使测出的x∶y的值_______________(填“偏大”、“偏小”或“无影响”)
(5)若改进实验后,最终装置B 质量增加m 克,装置D质量增加n克,则x∶y=________(用含m、n 的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内水和无机盐的叙述错误的是
A. 越冬或休眠的植物细胞中自由水与结合水的比例升髙,有利于其抵抗不良环境
B. 水既是细胞内良好的溶剂,又是生物体内物质运输的主要介质
C. 无机盐离子对维持血浆渗透压和酸碱平衡等有重要作用
D. 镁是构成叶绿素的必需成分,植物缺乏镁时会导致叶片发黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示( )
A.v(O2)=0.010 molL﹣1s﹣1
B.v(NO)=0.008 molL﹣1s﹣1
C.v(H2O)=0.006 molL﹣1s﹣1
D.v(NH3)=0.002 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的核电荷数依次增多。
①A的核电荷数大于2,其气态氢化物H2A在常温下是液体;
②A和B两元素可形成化合物B2A3,该化合物既能溶于酸,又能溶于强碱;
③C+比B3+多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2∶1。试回答:
(1)E是___________ (写元素符号)。
(2)B的离子结构示意图是:___________,D的单质分子的结构式:___________,C元素最高价氧化物对应的水化物的电子式:___________。
(3)化合物H2A的性质比较特殊,同温同压下其晶体(固体)密度较液体小。试解释原因:_________________________________。
(4)B2A3与强碱反应的离子方程式为____________________________,根据②我们可以推测出化合物B2A3的性质是:两性偏______(填“酸性”、“碱性”或“中性”)。
(5)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
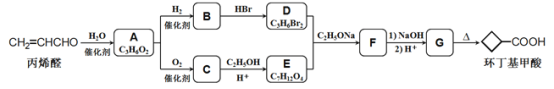
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物巳省略)。
已知:
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________
(2)化合物C的结构简式是________________________
(3)下列说法中不正确的是____________(填字母代号)。
A.化合物A能与 NaHCO3溶液反应
B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4
D.1mol化合物B与足量金属钠反应能牛成1mol氢气
(4)写出D+E→F的化学方程式:___________________________________
(5)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足下列条件的所同分异构体有____________种,写出其中一种的结构简式:________________________
①能使FeCl3溶液变紫色;
②含有丙烯醛中所有的官能团;
③1H-NMR谱显示分子中含有5种不同化学环境的氢原子
(6)以1,3-丁二烯和化合物E为原料可制备环戊基甲酸![]() ,请选用必要的试剂设计合成路线____________________________________________________________
,请选用必要的试剂设计合成路线____________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com