
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现.下列有关说法中,正确的是( )
A.H2与H3属于同素异形体
B.O2与O4属于同位素
C.C60的质量数为720g/mol
D.N5+中含有36个电子
科目:高中化学 来源: 题型:
【题目】在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是
A. FeCl3溶液有杀菌消毒作用
B. FeCl3溶液能使血液聚集沉降
C. FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D. FeCl3能使血液发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将2mol气体A与1mol气体B充入一个体积不变的容器内,发生反应:2A+BC+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
A.上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
B.在上述平衡体系中再加入1molA和0.5molB,平衡正向移动,A的转化率增大
C.该反应的热化学方程式2A(g)+B(g)C(g)+3D(l)+4E(g)△H=﹣QkJ/mol
D.该反应在任何温度下都可自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: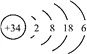 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应不能实现的是( )
A.S→SO3→H2SO4→SO2
B.N2→NO→NO2→HNO3
C.Na→Na2O→NaOH→Na2CO3
D.Al→Al2O3→Al2(SO4)3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
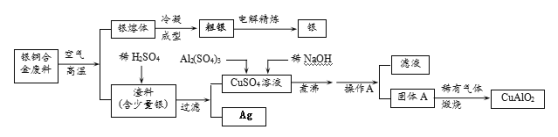
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g)C(g)+D(g)△H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的 ![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.从开始到平衡,A的反应速率为0.08mol?L﹣1?min﹣1
B.随着反应的进行,混合气体的密度逐渐减小
C.达到平衡时,B的转化率为20%
D.该温度下,反应的平衡常数K= ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com